高中化学常考的重要知识点(新教材最全高中化学物质分类)
物质的分类作为高一入门以及高三一轮复习的起点,无疑具有非常重要的基础性地位,涛涛老师把基础性知识全部汇总下来,期待你能够掌握心法,成就自己。以下内容822个字,均为该内容重点,先收藏再反复观看。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
重点内容如下:
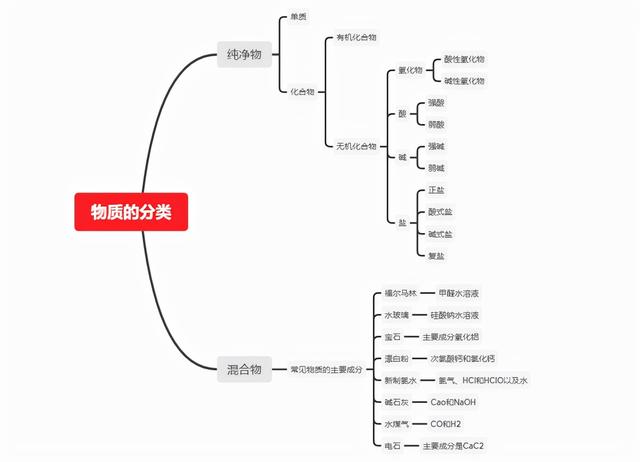
一、氧化物
1. 酸性氧化物:能与水反应只生成酸,或与碱反应只生成一种盐和水的氧化物
常见:SiO2 SO2 CO2 SO3等
常见的不是酸性氧化物的:NO2 CO NO
注意:Mn2O7也是酸性氧化物
2NO2 H2O=2HNO3 NO
2. 碱性氧化物:能与水反应只生成碱,或与酸反应只生成一种盐和水的氧化物
常见:CaO Fe2O3 CuO Na2O
常见的不是碱性氧化物的:Fe3O4 Na2O2
注意:Fe3O4 8HCI=2FeCI3 FeCI2 4H2O
2Na2O2 2H2O= 4NaOH O2
辨析:酸性氧化物一定是非金属氧化物(错误,Mn2O7)
碱性氧化物一定是金属氧化物(正确)
二、酸
六大强酸:HCI HNO3 H2SO4 HCIO4 HI HBr
常见弱酸(需要多积累):H2SO3 H2CO3 H2SiO3 H3PO4 HF H2C2O4(草酸) CH3COOH
HCIO H2S
强酸制取弱酸:强酸 弱酸盐=弱酸 强酸盐(复分解反应,这里就要注意,与初中不同,复分解反应发生的条件是:沉淀、气体或者弱电解质生成)
2HCI CaCO3 = CaCI2 H2O CO2
特殊:
1. 少量CO2通入到次氯酸钠溶液中
CO2 H2O NaCIO = HCIO NaHCO3
原因是: H2CO3>HCIO>HCO3-
2. 弱制强
CuSO4 H2S= CuS(沉淀) H2SO4
但是注意换成FeSO4不反应
3. 注意:CO2通入到氯化钙或者氯化钡溶液中不反应
三、碱
四大强碱:NaOH Ca(OH)2 Ba(OH)2 KOH
常见弱碱:NH3·H2O Fe(OH)3 Cu(OH)2
四、盐
1.正盐:金属阳离子或铵根离子与酸根形成的盐
常见正盐如:NaCI CH3COONH4 K2SO4 Ca(NO3)2
2.酸式盐:能够电离出氢离子的盐
常见酸式盐如:NaHCO3 NaHSO4 KHSO3等
注意:弱酸的酸式盐既能与强酸反应也能与强碱反应
3.碱式盐:能够电离出氢氧根离子的盐
常见的碱式盐如:Cu2(OH)2CO3 碱式碳酸铜 Mg(OH)CI 碱式氯化镁
4. 复盐:多种阳离子与酸根离子形成的盐
常见的复盐有:KAI(SO4)3 (NH4)2Fe(SO4)2
注意:看似简单实际出题者会考你下面这样的
NaHPO3 NaHPO2等
需要积累:H3PO3为二元酸,H3PO2为一元酸,如果还想深入学习,应该掌握从磷酸开始的结构式
五、酸酐(非必考,但需要了解)
1.定义:酸酐就是含氧酸脱去一分子或者几分子水剩下的部分
2.如H2SO4-H2O-SO3,所以SO3就是H2SO4的酸酐,这里我相信你应该可以举一反三的写出来H2CO3 H2SO3 H2SiO3的酸酐了
3. HCIO4的酸酐如何突破呢HCIO4-H2CI2O8-H2O-CI2O7,把里面同时乘以2再减去水分子就可以了,这里相信你可以举一反三写出HCIO H3PO4的酸酐了
4. 特殊:CH3COOH的酸酐为乙酸酐,(CH3CO)2O这就是乙酸酐
5. 注意:酸酐中元素化合价与原酸中相同;
酸酐不一定是氧化物,如乙酸酐
以上是涛涛老师对于高中化学物质的分类学习的分享,感谢阅读。
码字不易,费时费心,如果文章对你有帮助,还请花1秒钟点个赞
本文为作者原创,若需要转载需私聊,谢谢合作
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






