化学课跟不上(没聊够吧伤害不大但侮辱性极强的一节化学课)
快过年了,小五老师也没什么礼物送给大家,不如给大家讲一节化学课吧。
本节课对应人教版高中化学,必修一,
第三章 金属及其化合物,第一节 金属的化学性质,
第二小节 铝与氢氧化钠溶液的反应、物质的量在化学方程式计算中的应用
以下为文字版,建议有条件的同学观看上面的视频版。

一转眼,三个月都没有更新了,有不少同学私信问我为什么这么久不更新啊。我这么懒怎么可能回复呢,后来转念一想/还是象征性的回复一下吧,于是我就随意地找了一位名字里符号最多的同学,起名字都整这么多符号,化学肯定学得好。我语重心长的回复到:最近实在太忙了,又要备课,又得想段子,关键我还这么懒,巴拉巴拉一大堆,最后又祝这位同学学业进步。不久呀就又收到这位同学真诚的回复了,他就回复了四个字母,mlgb,然后就取关了。诶,我就盯着这四个字母陷入了沉思,mlgb,什么意思?不过以我的聪明才智,分分钟就整明白了,mlgb,“没聊够吧!”这四个字拼音的缩写。我说没聊够咱接着聊呀,取关干什么,现在的孩子,真是搞不懂。
好了,为了照顾一些给我留言说:不更新视频便便都不顺畅了的同学,以及其他也想跟我说“没聊够吧”的同学,咱就接着往下聊,今天咱们讲,第三章第一节的第二小节,铝与氢氧化钠溶液的反应、以及物质的量在化学方程式计算中的应用。

本节课呢,就这么点内容,咱一个一个给整明白咯。

首先来看第一部分,铝与NaOH溶液的反应。
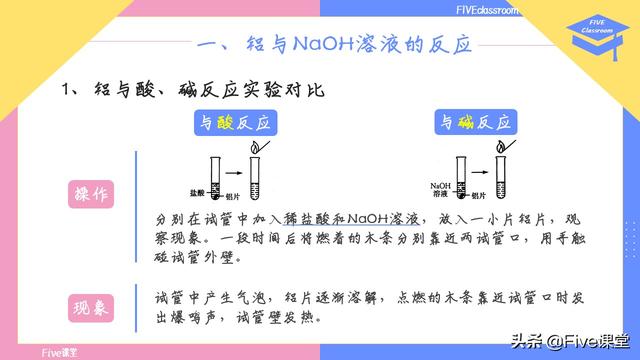
我们首先来看铝与酸、碱反应实验对比,
操作,分别在试管中加入稀盐酸和NaOH溶液,放入一小片铝片,观察现象。一段时间后将燃着的木条分别靠近两试管口,用手触碰试管外壁。其操作示意图如图所示,区别不大,就是试管中的溶液有所变化。
对于现象的完整描述如下,可以分成四条来记忆,避免造成记忆混乱:1、试管中产生气泡,2、铝片逐渐溶解,3、点燃的木条靠近试管口时发出爆鸣声,4、试管壁发热。其实一条一条地看的话,现象的描述和操作是一一对应的。

铝与盐酸、氢氧化钠溶液的反应方程式分别如下,这需要各位同学牢记。
这里插播一条学习方法小提示,牢记和死记、硬记是有区别的,牢记是要达到不需要去特别记忆就知道怎么写的这样一个境界,听起来很玄乎,其实操作起来很简单,只需要理解反应为什么会发生,理所当然地就知道反应能够生成什么了,自然而然的写出反应方程式,然后配平,需要的话标气体沉淀等符号,齐活。
好吧,知道给你们讲这些你们也不爱听,还有一个超简单的记忆技巧偷偷告诉你们,就四个字,抄同桌的,当然这招除了考试的时候不好使以外,其他时候都没毛病。
接着往下看,结论,(1)反应刚开始的时候,反应较慢,之后逐渐变快。这是由于以下两个因素共同导致:第一个原因,反应开始时铝片表面的氧化膜阻碍铝片与酸碱反应,随着反应进行,氧化膜溶解,反应速度加快;第二个原因,随反应进行,体系温度升高,反应速度也会加快。两个因素共同促使反应越来越快。
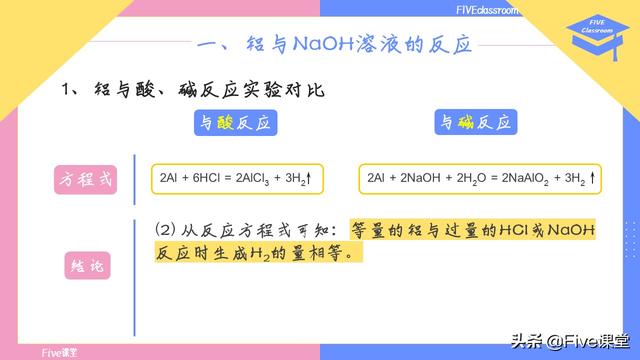
(2)观察反应方程式可知:等量的铝与过量的HCl或NaOH反应时生成H2的量相等。到了视频的第三部分,我们还会从电子转移的角度再次解释这个问题。

相信大多数同学第一次见到铝与氢氧化钠溶液的反应的时候,估计内心都会浮现出这样的弹幕:这反应不讲武德啊,mlgb。对,没聊够吧,那咱接着聊聊这个反应。
2、铝与NaOH溶液反应的实质
铝并非直接和NaOH反应,而是首先与溶液中的水反应生成Al(OH)3,而后Al(OH)3又继续与NaOH生成偏铝酸钠NaAlO2。本质上铝与NaOH溶液的反应分为两步。
第一步,即铝与水的反应,化学方程式可以表示为铝与水反应生成氢氧化铝沉淀和氢气,并配平标出沉淀和气体符号。将该反应标记为反应①。
第二步为所生成的氢氧化铝沉淀与氢氧化钠反应生成偏铝酸钠,方程式如下,将其标记为②。有没有看出一点门道呢,其实在这个反应中,NaOH只起到了使第一步中生成的Al(OH)3溶解的作用,下节课呢我们还会单独把这个反应拎出来讲。

这两步反应在溶液中是同时发生的,是以一种你中有我、我中有你的这种未成年人请在父母陪同下观看的状态而存在的,所以一般在写这个反应方程式的时候呢把这两步反应写在一个方程式中,即把这两步反应相加,可以得到如下方程式。
跟我们刚刚学到的方程式略有区别,区别就在于把反应中消耗的水和生成的水都表示了出来。以至于方程式看起来很罗嗦。所以我们课本上并没有给出这个方程式。
那么这个方程式有什么意义呢?当然有意义,只有把反应中的水全部表示出来,我们才能标出反应中的电子转移。
来看反应中的电子转移,铝失去六个电子生成偏铝酸钠中 3价的铝。那氢气中的H是由谁提供的呢?氢氧化钠么?开什么玩笑,刚才白讲了啊,氢氧化钠只起到了溶解氢氧化铝的作用,氢气是水中的氢离子得电子生成的。
也就是水中的氢离子得六个电子,生成氢气。
再来仔细研究一下反应方程式,右边的4个水是哪来的?是左边的六个水中的氢氧根离子先与Al反应生成Al(OH)3沉淀,紧接着Al(OH)3又跟NaOH反应所生成的。
学习到这里有没有一种豁然开朗的感觉呢?没有啊,看来是上帝在你面前遮住了帘忘了掀开啊。想掀开也容易,把视频倒过去再把这两步反应理解了帘子就掀开了。
接下来就进入到垃圾时间了,
所以反应中的还原剂为Al,而氧化剂是水,千万不要搞错。

最后再友情提示一下,书写铝与NaOH溶液反应电子转移时必须写出方程式中省略的4个H2O。下面的这种写法是不能写出电子转移式的。

最后来看无聊的易错点提醒。为什么说无聊呢,因为学会的,不提醒也不会错。学废的,提醒了照样错。不过为了避免收到更多“没聊够吧”这样的留言,这里还是简单给大家提个醒吧。
①Al与NaOH的反应中,还原剂为Al,氧化剂为H2O,NaOH既不是氧化剂也不是还原剂。
②常温下,Al在浓硝酸、浓硫酸中会钝化,不发生反应。
③Al与浓、稀硝酸反应均不生成氢气;Al与浓硫酸在加热条件下反应也不产生氢气。
④尽管铝制品表面有氧化铝组成的致密保护膜,但是氧化铝与酸、碱均能够反应,因此不宜长时间用铝制品保存酸性或碱性食物。

终于进入更加无聊且容易掉粉的第二部分了,那为啥还讲呢,因为这一部分地位过于重要,是几乎所有化学计算的基础,可以说学好这一部分是应付各类大小考试的基础,简直就是:不学不是中国人啊。

先来看计算的原理:物质是由原子、分子、离子等粒子构成,物质之间的化学反应也是这些粒子按照一定的数目关系进行的。
而化学方程式中的化学计量数可以明确的表示出化学反应中粒子之间的数量关系。

来看例子,例如对于氮气和氢气在高温高压下生成氨气的反应中,化学计量数比为1:3:2,因此,参与反应的各物质/物质的量、气体体积和分子数之比都为1:3:2。也就是说1 mol氮气与3 mol氢气生成2 mol氨气,或者说1 体积氮气与3体积氢气生成2体积氨气。又或者说每1个氮气分子与3个氢气分子反应,生成2个氨气分子。
但是质量之比并非1:3:2,而是相对分子质量×化学计量数之比,等于28:6:34。

了解了原理,我们来看一般解题步骤。
第一步,写,写出化学方程式。在做化学计算的时候,写化学方程式这一步至关重要,是解答一道题的基础,方程式写不出来的话这道题是万万没有解决途径的,并且我们在写方程式的时候不仅要写出正确的反应物和生成物,还要对方程式进行配平。所以我们拿到一道题,第一步一定是先写出化学反应方程式,况且退一步来讲,在所有考试中,只要计算题中写对方程式,就能得一步的分。既然咱们已经输在家庭背景上的起跑线上了,就别让化学方程式再拖咱们的后腿。
第二步,标,顾名思义,就是标出计算所需的相关量。
接下来,设,设未知数,这一步在解题的时候根据情况判断是否需要写出来,当使用常用符号来表示的时候,例如用n表示物质的量,V表示体积,m表示质量的时候,设的这一步可以省略不写。
再接下来,列,列出比例式,考试的时候这一步通常还是需要写出来的。不过在本视频中,为了提高各位同学便便的质量,使画面看起来不至于丑到让人便秘,在后面的例题中这一步就省略不写了,你们考试的时候该写还是要写,毕竟考试不是拉便便。
第五步,解,像解大便一样解出待求量。
最后,答,简要的写出答案。
以上为一般解题步骤,这里不再单独给出例题了,可以参考教材上的任意一道例题体会这几个步骤。另外,如果老师讲到现在你还能继续忍受/没摔手机的话,马上你就会看到其实你并不想听的例题了,当这些例题恶心到你的时候,你也可以对照解题步骤来减轻学习例题的不适感。

我们接着讨论过量问题的计算。
若反应中给出了两种或多种反应物的量,应该首先判断这两种反应物是否恰好完全反应,若不能恰好完全反应,则应该继续判断哪种物质能够消耗完全,哪种物质过量。
而我们在计算的时候,应该根据完全消耗的物质进行计算。
也就是说在我们遇到任何计算问题时,都应该首先通过化学方程式确定哪种物质过量。
遇到具体题目的时候,还要注意题目中可能出现的“陷阱”,例如最常见却很容易忽略的就是在有些题目中,反应物中过量的物质与反应的生成物仍能够继续发生反应。
接下来我们就通过一道例题来看看出题人是如何设置这类“陷阱”的。

例题,含0.2 mol NaOH的烧碱溶液,在标况下吸收CO2气体3.36L,所得溶液中含有什么物质(不考虑水),其物质的量各为多少?
老规矩,暂停视频,假装思考三分钟。
假装完了,我们一起来看。如果没有前面的视频给大家酝酿一下便便,哦不,酝酿一下这道题,而是直接给出这道伤害不大,但侮辱性极强例题,一定会有不少同学自信满满的答道,so easy! 体系里还剩过量的二氧化碳和生成的碳酸钠。但是过量的二氧化碳还能继续和碳酸钠生成碳酸氢钠呢,没想到吧,小丑竟然是你自己,后浪,耗子尾汁呀。
来看无聊的解题过程吧,友情提示一下,如果你还在厕所里蹲着,差不多可以出来了。再蹲一会腿麻了可能就出不来了呢,亲~。
第一步,求二氧化碳物质的量,题目中给出了标况下二氧化碳的体积,计算得到二氧化碳物质的量。
接下来我们就要判断是否能够恰好反应完全,以及谁过量的问题。我们可以假设其中的任意一种物质完全反应,计算另一种物质所需的量,即可判断哪种物质过量。演示中,我们假设NaOH完全反应,求所需的CO2的量,刚刚讲过的一般解题步骤应该也忘得差不多了吧,正好一起来复习一遍,首先写出反应方程式,标出相关量,
接下来,设未知数,现在我们要求CO2的物质的量,所以可以设CO2物质的量为n(CO2),当然,假设的这一步很多时候可以省略。
之后列出比例式,并解得未知数n(CO2),这里我们直接给出了结果,大家自己解题的时候建议写全。
计算得到,若氢氧化钠完全反应,需消耗二氧化碳0.1 mol,
0.1<0.15,因此二氧化碳过量。假如这里计算得到的数大于0.15的话,那说明是(语气放慢)对,氢氧化钠过量。
所以,题目中二氧化碳过量,氢氧化钠完全反应后还剩过量的CO2 0.05 mol未反应。
并且,我们还需要根据完全反应的NaOH求出生成的碳酸钠的量为0.1 mol。
到这一步可以先做一个小节,氢氧化钠完全反应,二氧化碳过量,并且有碳酸钠生成,因此此时体系中还剩过量的二氧化碳和生成的碳酸钠。到这里还不能掉以轻心,因为二氧化碳能够和碳酸钠继续反应生成碳酸氢钠。

同样,首先,写出第二步的反应方程式,并标出相关量。
根据刚才的计算我们很容易可以看出,此时体系中碳酸钠过量。因此这一步计算应该按照二氧化碳的量来算。
分别假设反应消耗的碳酸钠和生成的碳酸氢钠为n(Na2CO3)’和n(NaHCO3),计算得到两者物质的量分别为0.05 mol和0.1 mol。
此时,体系中的二氧化碳消耗完全,体系中只剩过量的碳酸钠和生成的碳酸氢钠。
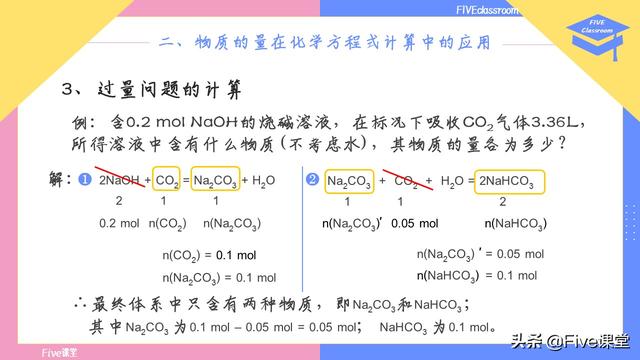
最后,把两步反应放在一起可以得出结论。
最终体系中只含有两种物质,即Na2CO3和NaHCO3 ;
其中Na2CO3的量为第一步生成的量减去第二步反应的量,即为0.1 – 0.05 = 0.05 mol; NaHCO3 为0.1 mol。

讲完了既难讲又难听懂的例题,我们来看点令人心情愉悦的理论知识吧,大家不必担心,后面还有好几道例题,保证能把大家恶心的透透的。
4、化学计算的特殊方法。(1)差量法。根据反应前后物质相关量发生的变化,找到“理论差量”,可以是反应前后的质量差、物质的量差、气体体积差等,该差量的大小与反应物的有关量成正比。
相信如果没学过这一方法会看的一头雾水,不如直接看索然无味的例题吧。
例题,铁粉与高温水蒸气完全反应后得到的干燥固体的质量比反应前铁粉的质量增加32 g,问参加反应的铁粉物质的量?
这道题看起来还真是有点棘手呢,不管题目好做与否,第一步写出反应方程式肯定不会错。

观察反应可以知道,
增加的固体质量是生成的四氧化三铁与反应消耗的铁单质的质量差。所以,我们可以利用差量法来解。
这道题中用到了质量差,所以你应该还不犹豫的在方程式的旁边写一个大大的Δm。
就像这样。Δm表示的就是反应前后固体物质的质量差。
题目中要、求参加反应的铁粉的物质的量,所以我们列比例式时,
就在Fe下面写上3 mol,那么此时Δm即为生成四氧化三铁的质量减去反应的铁单质的质量,
等于64 g。也就是每3 mol铁完全反应生成四氧化三铁,反应前后固体的质量差为64 g。
然后设未知数,列出方程式,并求解。可得铁的物质的量为1.5 mol。
综上,利用差量法解题的关键在于寻求差量与物质之间的比例关系。

(2)关系式法。
当已知物与待求物之间靠多个反应联系时,只需直接确定两者之间的比例关系式即可。
什么意思呢,我们还是来看例题。
例如:用CO还原Fe2O3,将生成的CO2通入澄清石灰水,求沉淀CaCO3的量。
沉淀CaCO3中的碳元素全部来源于CO2,而CO2中的碳元素又全部来源于CO。
因此可以得出结论,每一个CO分子与Fe2O3反应将会生成一个CO2分子,而每个CO2与氢氧化钙反应又会生成一个碳酸钙分子,因此CO与CO2与CaCO3的比例应该为1:1:1,所以可以得出关系式:一个CO对应一个CO2又对应一个CaCO3。而利用这个关系式,跳过了繁琐的中间步骤,直接将最初的反应物CO与最终需求解的生成物CaCO3联系了起来,使解题也变得更加容易。

(3)守恒法,质量守恒,宏观上来看是反应前后元素质量守恒。
微观上来看是反应前后的原子个数守恒。
得失电子守恒,氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。

电荷守恒,电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相同,即正负电荷总数相同。
离子反应方程式中,反应物所带电荷与生成物所带电荷总数相等,且电性相同。
以上这些守恒定律都可以在解题的时候灵活应用,增加解题的灵活性。

我们来看一道利用守恒法解答的例题,含0.2 mol NaOH的烧碱溶液,在标况下吸收CO2气体3.36L,最终体系中只含有Na2CO3和NaHCO3(不考虑水),求两种物质的量各为多少?
有没有觉得这道题很熟悉,废话,一秒钟前刚刚讲过,连数字都没变!这都没印象的话还是趁早买个炉子去路边卖烤红薯吧,算了,可能烤红薯并不适合你,毕竟烤红薯也需要控制煤炭与空气的混合比例调节燃烧速度控制炉内的温度,这样烤的红薯才能外焦里嫩,又香还省煤。看到没,化学学不好红薯都烤不香。
其实仔细阅读这道题,和刚才那道例题还是有一点细微的区别,这道题中直接给出了最终体系中只含有碳酸钠和碳酸氢钠这两种物质,如果题目中没有明确的给出这样的信息,我们还是需要通过计算判断过量问题。具体计算前面刚刚讲过,这里就不再啰嗦了,这么快就忘了的话建议预防一下阿尔茨海默症呢。
这里我们利用守恒法来解题,首先假设生成Na2CO3的量为x mol,NaHCO3为y mol。这里我们设了x和y这两个未知数而没有用n来表示物质的量,所以假设这一步一定要体现出来。
由于产物中的Na全部来自于NaOH,x mol Na2CO3含Na元素2x mol,y mol NaHCO3含Na元素y mol,根据Na守恒,所以有2x y = 0.2 mol。
再根据碳守恒,也就是产物中的C元素全部来源于参与反应的CO2,而CO2的量为3.36/22.4= 0.15 mol。同时x mol Na2CO3含C元素x mol,y mol NaHCO3含C元素 y mol,所以x y =0.15 mol。
解一下这个小学水平的一元二次方程,即可得到Na2CO3的量为0.05 mol,NaHCO3为0.1mol。怎么样,刚才讲了半天的解题方法是不是瞬间就不香了呢,利用守恒法解题是不是成了新的小甜甜呢?

估计拖堂是所有老师的通病吧,我视频的时间也变得越来越长了,没想到自己也变成自己曾经最讨厌的样子了。反正既然如此了,咱们索性把体育课的时间也占了吧,再来讲最后一个专题,Al与NaOH、HCl溶液反应的计算,好在这部分没什么技术含量,就当带着大家做准备运动了吧。

1、Al与HCl、NaOH溶液放出H2情况的讨论
方程式,我们已经讲过很多次了,不再重复,放在这里,方便后面内容的讲解。
我们来分情况讨论,反应中放出的H2都是溶液中的H 还原而来,而H 还原所得到的电子均来自参与反应的Al,因此不论是与酸或碱反应,都遵循2Al~3H2这一关系式(得失电子守恒)。
所以当Al的量相同且均完全反应时(即Al为少量时),不论与酸或碱溶液反应生成的H2的量均相同;即V(HCl) : V(NaOH) = 1 : 1 。

当Al过量时,根据方程式可以分别得出如下关系式:
6HCl~3H2,即2HCl~H2;
2NaOH~3H2 ,即2/3NaOH~H2
所以若生成相同体积H2时,所需n(HCl): n(NaOH) = 2: (2/3) = 3 : 1。
也可以说是,等物质的量的HCl和NaOH与过量的Al生成的氢气体积比为V(HCl) : V(NaOH) = 1 : 3。

依然根据两反应方程式,我们又可以得出如下比例:
2Al~6HCl,即Al~3HCl,又或者 1/3Al~HCl;
2Al~2NaOH ,即Al~NaOH。
所以若Al的量相同,且在两种反应中,一种铝过量,另一种铝少量的时候,一定是HCl溶液中的铝过量,而与NaOH反应的铝为少量。

所以,根据上面的推论,等物质的量的HCl和NaOH分别与Al反应时,
若Al均为少量时,那么与盐酸和氢氧化钠反应放出的氢气体积相同,即V(HCl) : V(NaOH) = 1 : 1,而Al均为过量时V(HCl) : V(NaOH) = 1 : 3;
若Al在一种溶液中过量,另一种溶液中少量,则生成氢气比一定介于这两者之间。即/< (V())/((aOH)) < /,且一定是HCl溶液中Al过量,NaOH中Al少量。

快速做一个小节,咱们赶紧把这节令人讨厌的化学课结束了。
左边一列为反应条件,右边一列为生成H2体积比。
等物质的量的Al分别与足量的HCl、NaOH溶液反应时,V(HCl)/V(NaOH) = 1 : 1;
足量的Al分别与等物质的量的HCl、NaOH溶液反应时,V(HCl)/V(NaOH) = 1 : 3;
相同量的Al分别与HCl、NaOH溶液反应,且一种过量,一种不足量时,/< (V())/((aOH)) < /,并且一定是HCl溶液中的铝过量,NaOH中少量。
参与反应的盐酸与氢氧化钠比为3:1时,生成氢气比为1:1。

终于到了跟大家说再见的时候了,我们下期再见,考虑到刚才在线表演了一下拖堂这一伟大技巧,估摸着不少同学已经果取关了,另外也不知道下期视频会什么时候才能更新,那还是给大家说一声有缘再见吧~同学们,拜拜~
。。。。。。。。。。。。。。。。。。。。。。。。。。。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com