微粒分散体系物理变化(物质的分散系知识点)
4物质的分散系知识点
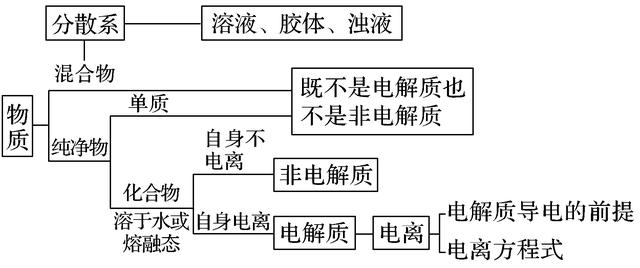
一、分散系
1.分散系的概念
(1)概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
(2)组成:分散系中被分散的物质称作分散质,起容纳分散质作用的物质称为分散剂。
2.分散系的分类
当分散剂是水或者其他液体时,根据分散质粒子直径的大小,分散系可分为三类:
(1)分散质粒子直径小于1nm的分散系是溶液;
(2)分散质粒子直径大于100nm的分散系是浊液;
(3)分散质粒子直径在1~100nm之间的分散系是胶体。
3.胶体的性质与应用
(1)丁达尔效应:当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路的现象。常用于鉴别胶体与溶液。
(2)氢氧化铁胶体具有吸附性,常用于净水。
(3)胶体的应用
①铁盐和铝盐用作净水剂。
②改进材料的机械性能和光学性能。
③医学上利用高度分散的胶体来检验或治疗疾病。
④广泛用于冶金工业中的选矿、石油原油的脱水、有机高分子材料的制造。
4.溶液、胶体、浊液三类分散系的比较
(1)溶液、浊液、胶体三种分散系本质的区别是分散质粒子直径的大小不同。

(2)分散系都是混合物而不是纯净物。
分散质粒子的直径介于1~100nm之间正是胶体区别于其他分散系的本质特征,也是胶体具有丁达尔效应等特有性质的根本原因。丁达尔效应是区别溶液和胶体的最简便方法,而不是胶体与其他分散系的本质区别。
二、电解质和非电解质
1.概念
(1)电解质:在水溶液里或熔融状态下能够导电的化合物。常见的电解质有酸(如H2SO4、H2CO3等)、碱(如NaOH、NH3·H2O等)、盐(如NaCl、CaCO3等)、部分氧化物(如CuO、H2O等)。
(2)非电解质:在水溶液里和熔融状态下均不能导电的化合物。常见的非电解质有多数非金属氧化物(如CO2、SO2等)、大部分有机物(如蔗糖、酒精等)、部分非金属氢化物(如NH3等)。
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨气等是非电解质)。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
2.电解质(酸、碱、盐)在水溶液中的电离
(1)电离的概念
电离是电解质溶于水或受热熔化时,离解成自由移动离子的过程。
(2)表示方法——电离方程式
电离方程式是用化学式和离子符号表示电解质电离过程的式子。写出下列酸、碱、盐的电离方程式:
①硫酸(H2SO4):H2SO4===2H++SOeq \o\al(2-,4)。
②氢氧化钠(NaOH):NaOH===Na++OH-。
③硫酸钠(Na2SO4):Na2SO4===2Na++SOeq \o\al(2-,4)。
(3)从电离角度理解酸、碱、盐:

电离方程式书写注意事项
(1)符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
(2)质量守恒,即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒,即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
特别提示——电解质和金属导电的不同
(1)条件不同:电解质必须溶于水或受热熔化时才能导电。
(2)原理不同:在外电场的作用下,电解质是阴、阳离子发生定向移动,而金属是电子发生定向移动。
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






