神经源性膀胱功能障碍(神经源性下尿路功能障碍的物理治疗)
本章总结了脑血管意外(中风)、多发性硬化症(MS)、帕金森病(PD)和脊髓损伤(SCI)后神经源性下尿路症状(LUTS)患者的泌尿系统主诉的物理治疗。这种治疗特别旨在通过膀胱训练,盆底肌肉训练,生物反馈,电刺激和抑制冲动技术(组合)来恢复患者控制自己膀胱功能的能力。多学科康复的这一方面极大地促进了患者的自尊心,并有助于提高生活质量。
介绍
物理治疗在不同神经系统疾病患者中膀胱和出口问题的作用在很长一段时间内很少被研究。然而,目前,神经系统患者的泌尿科护理不再仅包括医疗干预或药物治疗。特别是,通过训练,反馈,电刺激和转换丢失的功能来恢复患者的功能,在多学科康复中赢得了一席之地。大多数患者高度赞赏治疗的这一方面,可增强患者的自信心和身体形象,并改善功能结局和社会参与。几种神经系统疾病可能并发神经源性膀胱功能障碍。在美国的患者中,40-90%的多发性硬化症(MS)患者、37-72%的帕金森综合征患者和15%的脑卒中患者发现了该病[1,2,3]。此外,据估计,70-84%的脊髓损伤患者至少有一定程度的膀胱功能障碍[4]。这些泌尿系统症状随着时间的推移而发展,因此需要定制治疗。
脑血管意外
2019年,有1.015亿人患有脑卒中,660万人死于脑血管疾病[3]。大约32-79%的中风患者在中风后入院时患有尿失禁。这凸显了问题的严重性[3]。尽管文献中泌尿系统症状的患病率差异很大,但在初始事件发生后3个月,这些数字的发生率为10%-51%[3]。此外,卒中后尿失禁是死亡率和更高机构化的强预测因素[3]。Patel等人调查了脑中风后尿失禁的自然病程,发现尿失禁从3个月时的19%逐渐自发改善至1年时的15%和2年时的10%[5]。其他研究显示,入院时尿失禁的范围为32-79%,出院时25-28%,卒中后6个月尿失禁12-19%[6,7],脑卒中后1年持续性UI尿失禁的范围为9-38%[8,9]。最初,大多数中风患者患有尿潴留。之后,最常发生的泌尿系统症状是夜尿、尿急、日间频率和尿急性尿失禁。Mehdi等人[3]已经指出了中风后UI的复杂起源,直接或间接地与脑血管意外有关(图1)[3]。尽管目前的数据尚无定论这些病因中哪些与更差的卒中结局相关[3],但确定中风后排尿功能障碍的根本原因有助于优化这些患者的治疗[12]。
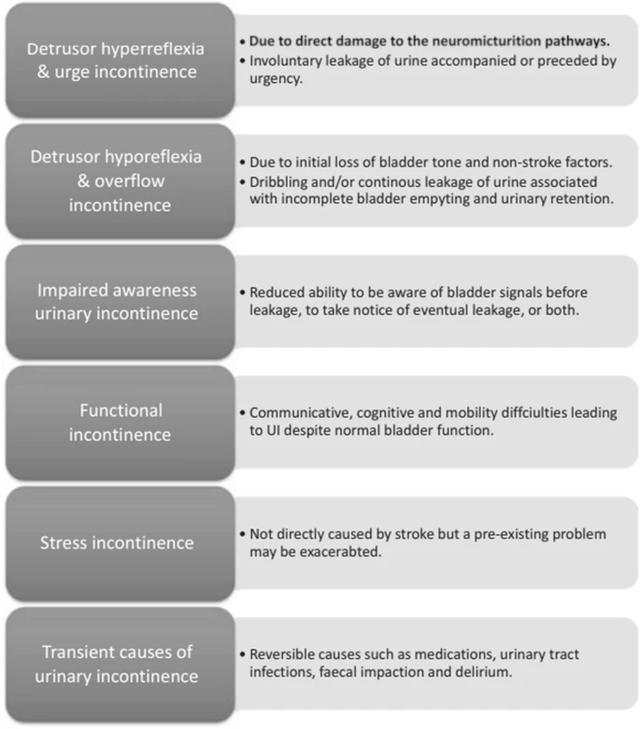
表示中风后尿失禁的原因和类型的示意图,源自Mehdi等人(国际J Clin Pract,2013)
神经显微通路的破坏导致不受抑制的膀胱收缩和伴随的急迫性尿失禁。患病率为37%-90%[3]。然而,只有两项研究可以证明卒中病变部位(主要是额叶和基底神经节)与急迫性尿失禁和逼尿肌反射亢进之间的关系[10,13]。21-35%的患者也报道了逼尿肌反射减弱,主要见于最初膀胱张力丧失导致的急性卒中[3]。然而,必须考虑使用抗胆碱能药物和糖尿病性多发性神经病。因此,膀胱信号意识受损的患者往往认知和功能独立性较差,因此在3个月和12个月时结局较差[3]。此外,沟通、认知和行动困难可能会间接影响患者及时上厕所的能力。压力性尿失禁可能已经存在,因为卒中患者的平均年龄为65岁或以上,但可能由于运动无力而恶化。最后,应解决导致泌尿系统不适的短暂性病因。
管理
膀胱过度活动症卒中患者的一线治疗是行为治疗:膀胱训练、冲动抑制、盆底肌肉训练和液体管理(排尿图)。物理治疗的一般目的是加强或放松骨盆底肌肉,减少频率、尿急和夜尿。
一般而言,膀胱训练的目的是(1)增加/减少膀胱容量,(2)改变饮酒习惯,(3)改善尿频和夜尿行为,以及(4)使尿急变得正常[14]。因此,膀胱训练可以改善甚至解决尿失禁。最简单的膀胱训练方法(表1中提供的示例)使用排尿图。排尿图允许患者指示白天和晚上排尿的时间,频率和数量。此外,可以记录饮酒时间以及消费量和类型。此外,可以写下垫中的尿液损失(通过在秤上以1 g的精度称量垫)。最后,紧迫性可以用5分的李克特量表评分:(1)没有紧迫性;(2)轻度尿急;(3)中度紧急;(四)急症严重;(5)与尿尿无关的尿急性尿失禁。
From:
Physiotherapy for Neurogenic Lower Urinary Tract Dysfunction: Methods and Indications
Day Time (h) Volume of micturition (ml) Urine loss (grams) Urgency 02.00 250 4 05.00 100 3 08.00 250 ml coffee 120 4 10.30 150 ml coke 200 3 13.00 100 ml water 150 3 15.00 100 4 18.00 150 ml coffee 220 35 g 5 20.00 200 3 22.00 200 ml wine 100 4 23.00 150 2 排尿图首先具有重要的诊断功能;否则,它也将引导治疗。例如,在上面演示的示例(表1)中,需要建议患者饮用较少的“刺激性”饮料(含有咖啡因/茶氨酸/酒精的饮料)。此外,这位病人喝得很少。应建议每天至少摄入1.5升液体(以防没有其他合并症禁止这样做)。显然,该患者的膀胱容量很小。在成人中,正常的膀胱容量位于300至500毫升之间。因此,体积小且排尿频率增加提示异常[16]。此外,紧急性和紧急性尿失禁可以从图表中得出。根据患者的认知/活动障碍或患者是否处于急性期或慢性期,治疗师可以选择是否可以在治疗中实施饮酒习惯,排尿习惯或两者兼而有之。为了加强或放松骨盆底并学习抑制冲动的技巧,文献中建议进行骨盆底肌肉训练[17]。骨盆底肌肉训练计划的持续时间和范围在文献中差异很大。然而,一般来说,骨盆底肌肉训练计划应包含以下项目:解释与尿失禁相关的解剖结构,并教患者在第一次会议期间收缩骨盆底肌肉的正确技术。使用正确的骨盆底肌肉收缩技术后,不应观察到其他肌肉的屏气或收缩,治疗师应使用阴道/肛门触诊检查收缩。由治疗师手动控制的盆底运动(阴道/肛门触诊)可以补充肌电图生物反馈(关于骨盆底肌肉收缩的听觉和/或视觉反馈)。应教导患者短收缩(以增强其力量)和长收缩(以提高耐力)。此外,需要教导患者在可能导致尿液流失的活动之前和期间收缩骨盆底肌肉,例如咳嗽,打喷嚏等(又名“诀窍”)。除了由经验丰富的治疗师指导的课程外,患者还必须进行家庭锻炼计划,每天在不同的位置(仰卧,坐下和站立)进行大约三次锻炼(每次重复20-30次)。在紧急情况下,需要向患者传授抑制冲动的技术。特别是,应该向患者解释,通常当一个人试图排尿时,膀胱收缩和骨盆底需要放松。为了使用冲动抑制,骨盆底肌肉在至少10秒内收缩抑制膀胱收缩。至关重要的是告诉患者,他/她应该首先抑制冲动感,然后走向厕所。如果冲动抑制(骨盆底收缩)与上厕所相结合,这通常会导致冲动抑制不足。电刺激可以成为教导患者正确的骨盆底肌肉收缩以抑制冲动的有用工具。电刺激可用于刺激神经纤维和盆底肌肉,通过神经反射环。因此,力量的增加和对如何以及何时收缩骨盆底肌肉的意识应该使患者在紧急情况下更加意识到收缩他/她的骨盆底肌肉。通过这种方式,抑制了非自主逼尿肌收缩或皮质收缩,并使用33-70 Hz之间的刺激[17,18]。继发性,在5-10 Hz时,电刺激也可以通过反射抑制影响逼尿肌。在此频率下,至盆腔神经反射被激活(参见下颌)。如果患者有严重的行动不便,治疗师应最大限度地专注于提高患者的独立性水平:使用一只脚/一只手或一根手杖,使用患者可以轻松脱下的衣服(如运动裤/紧身裤),并将卫生纸放在患者不受影响的一侧,用轮椅独立转移到浴室。...
5项随机对照研究调查了盆底肌肉训练对脑卒中患者下尿路症状的影响。关于生活质量参数,接受PFMT的组和对照组之间未发现差异。然而,脑卒中后尿失禁女性排尿频率、24小时家庭垫试验以及骨盆底肌肉的力量和耐力均有显著改善。在有中风后下尿路症状(LUTS)的男性中,与标准康复计划相比,在PFMT治疗12周后与尿失禁或生活质量相关的参数方面,没有发现显著改善。此外,在3项研究中研究了脑卒中后尿失禁或神经源性膀胱过度活动症患者[27]的神经肌肉电刺激的影响。电刺激最初是一种被动再教育,与PFMT相反,PFMT需要主动肌肉工作和完整的神经通路。然而,可以在一段时间后要求患者的积极合作,例如,通过与生物反馈相结合。目的是让患者配合电诱导的收缩,从而增加皮质意识和控制(参见M章De Sèze)。在尿失禁的治疗中,选择耐受性良好的电流形式,对称双相低频繁电流。这种类型的电流是本体感觉和肌肉加固的首选。可以使用肛门或阴道探针。需要设置五个参数:频率,脉冲持续时间,治疗持续时间,活动和休息时间。虽然关于理想频率仍未达成共识,但可以假设以下一般规则:5-10 Hz用于治疗急迫性和急迫性尿失禁并改善肌张力(膀胱抑制反射活动正常化[28]),33-70 Hz用于改善本体感觉和力量。频率越低意味着肌肉疲劳越少[14]。脉冲持续时间通常位于200至600微秒之间。冲动持续时间越低,患者的舒适度越高。休息期(压力性尿失禁患者)应为活动时间的两倍,即 16 秒休息与 8 秒收缩。在急迫性尿失禁患者中,应使用恒流。最后,强度应尽可能高,至少在骨盆底肌肉达到适当收缩并且患者不会感到疼痛不适之前。在神经系统患者中,对强度的谨慎尤其重要,因为它们通常不表示由于感觉问题引起的疼痛或不适。
在目前脑卒中患者的文献中,电刺激的参数在不同研究中存在很大差异(郭和康[2018] [24],30'/d,10周,脉冲持续时间为250 μs,频率为50 Hz;郭等[ 2014] [25],30'/d,60天,脉冲持续时间70 μs,频率75 Hz;Liu等人[2016] [26],30'/d,90天,150 μs,频率为20/75 Hz;Monteiro等人[2014] [27],30'/d或2*/w,45天,脉冲持续时间为200 μs,频率为10 Hz),但结果非常相似。特别是尿急、尿频、夜尿和急迫性尿失禁显著改善。
多发性硬化症
2016年,登记了约220万例MS流行病例和约19,000例MS死亡[29]。由于下尿路症状在MS患者中很常见,因此专门的物理治疗是这些患者康复的重要组成部分。在MS症状首次出现时,只有10%的患者出现泌尿系统症状[28]。超过90%的MS患者在发病10年后出现一些泌尿系统症状[28]。虽然发病率随着疾病进展而增加,但这些症状不一定与疾病的持续时间或残疾程度有关[30]。最常报告的尿路功能障碍是逼尿肌过度活动(>60%)、逼尿肌括约肌协同不良(25%)和逼尿肌收缩压低(20%)[1,31]。在临床实践中,这意味着尿急和尿频增加。此外,还报告了尿失禁,通常是急迫性尿失禁。排尿症状(如犹豫、血流不畅和排尿困难)和排尿后症状(如排尿后残留)通常与上述下尿路症状共存[1,31]。此外,49%的MS患者发现便秘,而14-32%的患者出现大便失禁[32,33]。关于MS患者的肠功能障碍,MS患者的文献相当稀缺。然而,多学科团队应始终对肠功能障碍提出质疑,因为这可能对紧迫性(尿失禁)的发展/进展产生最大的影响。
管理
定时排尿或固定时间表排尿可以作为PFMT的附加疗法,但在文献中,也建议不能参加独立如厕的患者使用。因此,它声称对严重认知和/或身体受损或依赖照护者的尿失禁管理是有效的。此外,还推荐用于治疗急迫性和功能性尿失禁,或与不稳定逼尿肌收缩相关的尿失禁,如神经源性患者[34]。可以建议按照固定的排尿方案,应用1.5-2升的液体摄入量。液体摄入量应分散在一天中,在睡前的最后3小时内摄入有限的液体量。根据每次消耗的体积(150-200毫升/次消费),患者将达到1.5-2升/天的总量。
定时排空方案 上升时 上午 午餐时 午后 晚餐时 晚上 睡前 饮酒计划(消费数量) 2 1 2 1 2 1–2 0 双重排尿鲜为人知,但是指在马桶上花费额外的时间,通过在完成排尿后保持坐姿,向前和向后倾斜,从一侧移动到另一侧,站起来并再次坐着等,然后进行新的排尿尝试来完全排空膀胱。该技术也适用于主诉排尿后排尿的患者。完全排空膀胱的另一种可能性是在完成排尿后收缩/放松骨盆底肌肉一次或两次,然后进行新的排尿尝试。
已经发表了10项关于盆腔再教育(和电刺激)对减轻MS患者下尿路症状的作用的随机对照试验]。5项研究为实验组提供了PFMT,并得出结论,对尿失禁发作次数、每日卫生巾数和夜尿症有显著影响。此外,据报道生活质量评分有所改善,残疾率降低。Khan等人[35]为患者提供了为期6周的膀胱管理计划,其中包括排尿图、严格的体液平衡、骨盆底锻炼以及定时排尿和双排尿策略[35]。
5项研究证实,ES对盆底肌肉锻炼对MS患者的下尿路症状具有额外作用。
帕金森病
据估计,帕金森病影响1%的60岁以上人群[45]。总体而言,全世界有多达一千万患者患有这种疾病。受影响的男性略多于女性。在疾病的早期阶段,大多数患者不认为泌尿问题令人不安,或者症状通常无症状。然而,在疾病早期进行的尿动力学研究显示,在约84%的患者中,异常并不令人不安,甚至没有被患者注意到[46]。后来,在运动问题开始后,尿液控制障碍向前迈进。这些障碍包括尿频、尿急和尿失禁。81%的患者报告了频繁的夜尿症,并归因于夜间多尿和逼尿肌过度活动[47]。逼尿肌过度活动与疾病分期相关,并随着疾病进展而增加[48]。排尿症状不太常见,通常包括不同程度的犹豫、排空不完全、排尿不完全、排尿紧张、间歇性,有时还包括潴留。逼尿肌活动不足也可能发生(10-15%),逼尿肌括约肌协同不良罕见(0-3%)[47]。
此外,PD患者还经常患有便秘,患病率为70%至80%。因此,导致僵硬和运动缓慢的相同大脑变化(平均结肠运输时间为1.8-7天)也会影响参与吞咽和推动食物通过消化系统的肌肉[49]。此外,肠道中的细胞损伤可能是PD发作的第一个迹象,因为肠道内的神经元也含有例如路易体。最后,对于 PD 患者的合并症(例如良性前列腺增生),需要谨慎,因为大多数患者年龄在 60 岁以上,因此会引起类似的主诉。尸检研究观察到,在生命的第4、6和90年,组织学患病率分别为8%、50%和80%[51]。此外,全面的用药史是评估的基础,因为抗帕金森病药物可加重和缓解PD患者的膀胱症状,通常取决于分期[52]。另一方面,抗毒蕈碱药物是膀胱过度活动症的一线治疗,但可能加重PD相关性便秘和口干(口干)。
管理
尽管 PD 患者中 LUTS 的患病率很高,但治疗选择仍然相当有限,并且通常耐受性较差或无效。大多数治疗方案来自对神经系统患者LUTS一般管理的指导[2]。膀胱日记提供有关 LUTS、液体摄入量、尿量、排尿频率和尿量的前瞻性和实时信息。如前所述,该日记应用于诊断和进展目的,并构成膀胱训练的基础。
PD患者在起床时使用扶手在浴室和床扶手中支撑自己。手杖,助行器和轮椅是从床上到浴室使用的良好动态辅助工具。此外,应使用对比色和充足的照明来充分进入浴室。地毯或杂物应从通往厕所的路上移开。对于步态冻结、姿势不稳定和睡眠药物的患者,使用小便池或床边马桶可防止漏液和跌倒。仅有2项研究将行为干预(液体管理和便秘管理教育)、盆底肌肉锻炼(肌电图生物反馈和每日家庭锻炼[45次宫缩/天])和冲动抑制策略(对白天和夜间的感觉或紧迫感做出适应性反应)相结合,在8周内进行了5次指导就诊[54, 55].第一项研究纳入了20例无对照组的患者,结果发现每周尿失禁发作和生活质量评分均有相关结果[54]。第二项研究是一项随机对照试验,共纳入53例患者[55]。对照组接受了镜像形状的绘图练习。结果,两组都报告了每周尿失禁发作的减少和OAB症状的改善;然而,两组之间没有差异。只有生活质量测量和症状困扰在两组之间有显著差异,有利于治疗组。
经皮(皮肤表面的电极)胫神经刺激和经皮(针穿过皮肤)胫神经刺激(TTNS/PTNS)被证明可有效治疗PD患者的LUTS。3项研究显示,12周的PTNS治疗对尿频、尿失禁、尿急和夜尿发作均有有益影响[56,57,58]。此外,无效的交易量在统计上有所改善。患者接受PTNS治疗12周,每周一次,每次30分钟。一项研究在5周(30分钟/疗程)内向8名局灶患者提供TTNS,向5例PD患者提供假TTNS,每周2次[59]。同样,在紧急感和夜尿症发作的数量方面发现了有利于治疗组的积极影响。此外,这些患者在强烈排尿欲望和紧急容量时膀胱内容量有所改善。
脊髓损伤
没有可靠的全球患病率估计,但估计全球年发病率为每百万人口40-80例。这些病例中高达90%是由创伤性原因引起的(WHO-2013年SCI实况报道)[60]。约 78% 的 SCI 新发患者为男性。脊髓损伤后,立即发生脊髓休克期,因此,逼尿肌反射消失(导致尿潴留)。患者需要导尿。几周到几个月后,如果病变位于骶骨排尿中心上方(S2-S4,=反射膀胱),逼尿肌反射将逐渐恢复。在骶下病变(髓圆锥或马尾)的情况下,逼尿肌反射将保持(部分)缺失(=自主神经膀胱)。在骶上病变中,逼尿肌过度活动是最常见的主诉,可能伴有逼尿肌-括约肌-协同失调,导致典型的漏尿、水疱反流和可能的潴留主诉。在骶下病变中,膀胱通常不屈曲,括约肌复合体通常活动不足,导致用力时漏尿和尿潴留。约81%的患者在SCI后1年报告膀胱问题。在反射膀胱或自主神经膀胱患者的基本治疗方案中,盆底物理治疗不是治疗的标准部分。因此,证据相当有限。
管理
通常患者最初并不知道骨盆底肌肉收缩和松弛之间的区别。此外,他们通常无法在排便期间应用正确的推力行为。然而,最重要的是要告诉患者收缩、放松和推挤之间的区别。因此,使用阴道/肛门探针的生物反馈可以帮助病变不完全的患者将反馈与正确的盆底运动(放松/收缩)联系起来。此外,使用探针/直肠球囊可以为这些患者提供一些关于推力行为的“反馈”。因此,建议始终首先教患者推出简单的肛门探针。之后,可以引入具有小膨胀体积的直肠球囊,以提高患者区分收缩和推挤的能力,并在更真实的情况下学习正确的推力行为。因此,要通过盆底肌肉训练( 生物反馈)来训练这些患者,骶骨皮节(减少/改变)中至少具有一定的敏感性是必不可少的。建议在康复阶段的早期将患者转诊至骨盆底治疗师进行初步摄入和评估。如果根本无法观察到活动/敏感性,患者应在几周后返回进行另一次尝试。在很少活动的情况下,骨盆底肌肉训练可以从那一刻开始。只有三项研究调查了PFMT对SCI患者的影响。所有研究仅纳入病变不完全的患者[62,63,64]。因此,这些患者具有盆腔区域的剩余感觉和盆底肌肉自愿收缩的能力。Shendy等人纳入了30例T12以上不完全病变的患者[62]。将患者随机分为PFMT和TENS组和PFMT和BF组。经过12次(6周)的训练后,没有看到组差异,但在TENS组中,发现最初排尿时膀胱体积,最大膀胱容量,最大流速和骨盆底肌肉的力量显着改善。BF训练仅导致最大流速的显着改善[62]。Elmelund等人将36名患有不完全性SCI的女性(6名颈椎,8名胸椎和12个腰椎)分配到PFMT或PFMT联合阴道内ES,每天在家中持续12周。训练期结束后,ICIQ-UI-SF组间在12周和24周时尿失禁发作方面没有差异。然而,PFMT组在12周时的ICIQ-UI-SF评分和每日尿失禁发作以及ICIQ-UI-SF、尿失禁发作次数、最大功能性膀胱容量和24周时的24小时垫试验方面均有显著变化[63]。最后,Vasquez等人指出,在两个案例研究中,为期6周的PFMT训练计划提高了骨盆底肌肉的力量和耐力。患有AIS D的受试者能够通过自愿PFMT收缩几乎完全降低过度活动期间的膀胱压力,并减少尿失禁。受试者2(AIS C)实现了膀胱压力的较小降低,并且尿失禁没有变化。
上述研究中使用的电刺激总是用于本体感觉目的的刺激,不要与神经调节混淆。结果,仅包括病变不完全(骶骨反射弧完整)的患者。相反,神经调节刺激S3根部的传入感觉纤维,其对中枢神经系统中的排尿和尿失禁反射通路具有调节作用(参见神经调节一章)。只有两项研究纳入了病变(n)完全的SCI患者,并为他们提供了TTNS(2*/W,4 W)与索利那新[65]或TTNS(每日,2 W)与背侧神经刺激的比较。在这两项研究中,PTNS组的导管插入量改善,尿失量减少。然而,组别无显著差异。最后,必须强调的是,日常家庭锻炼(理想情况下每天分散三次,注意快速抽搐和慢抽搐纤维)在这些患者中非常重要,应该在他们的日常康复计划中实施。
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






