生物模板法制备光催化材料(硅-氧原子转换构建荧光染料助力生命科学研究)
本文作者:孙晓龙 西安交通大学
2008年,肖义、钱旭红等人提出了长波长荧光染料设计的“元素替代”策略 [1]。通过用硅取代罗丹明染料的氧桥原子,研究者获得了近90 nm的荧光发射波长红移。同时,新型硅取代染料保持了与传统罗丹明相似的高亮度和稳定性,这一开创性的工作为荧光染料的设计开发和生物成像应用研究奠定了坚实的基础。元素取代染料的设计理念非常实用,国际众多研究团队开发出了一系列硅-罗丹明衍生物作为荧光染料或光学探针,为研究生物学问题提供优异的光学工具。这一战略创新也极具启发性,指导了许多奇妙的元素取代染料设计开发理念,其中元素不再局限于硅,染料前体也不局限于罗丹明。近期,该团队将这个最初的概念整理成文,作为一个教程指导,简要总结了这一策略的主要实践方法。最后展望了元素取代荧光染料的发展趋势 [2]。
1. 用Si取代O的最初概念:染料化学研究的突破
在染料化学的发展过程中,没有一种染料在共轭骨架中含有硅原子,但用硅取代罗丹明的O桥原子的非常规操作理论上是可行的。在元素有机化学领域,硅取代电子系统一直是许多研究的主题,肖义、钱旭红等人证明了Si-C π电子可以离域到硅空轨道。此外,在光电子材料领域,噻咯(硅环戊二烯)由于LUMO能量极低,也被发现具有非常高效的电子传输能力。基于此,他们巧妙设计开发了第一个硅取代罗丹明类似物2, 7-N, N, N’, N’-四甲基-9-二甲基-10-氢-9-硅蒽(TMDHS),并提出了一种涉及有机金属的简便合成,以获得这种新型含硅环π电子体系,如图1所示 [1]。

图1. 硅基罗丹明合成路线
通过桥原子上的硅取代,染料TMDHS具有比传统罗丹明波长更长的强荧光(图2),比如传统染料Py紫外可见吸收波长位于λabs = 552 nm,发射波长位于λem = 569 nm;改造后染料TMDHS吸收波长红移至λabs = 641 nm,荧光发射波长λem = 659 nm。一方面,TMDHS优异的光谱特性使其成为一种新型荧光染料家族的母体,具有广泛的应用前景。另一方面,利用硅空轨道进行π电子离域化是一种合理的、可扩展的策略,这标志着荧光染料设计新阶段的开始。

图2. 传统染料Py与硅元素替代的染料TMDHS
2. 硅基罗丹明:推动荧光传感发展的多功能染料家族
自从硅-罗丹明家族的第一个成员TMDHS建立以来,硅-罗丹明家族的快速增长是其重要价值的最好证明。在过去14年里出现了大量关于进一步优化结构设计、化学合成和生物应用的实例,它们在远红光和近红外光谱区域的长波发射比在可见光区域的常规罗丹明具有更好的优势,已被广泛应用于细胞、组织和活体成像的荧光识别和标记。
关于硅-罗丹明染料丰富的研究成果可以大致归纳为3类。1)对结构进行修饰,以进一步增强亮度和光稳定性等,从而提高成像质量;2)设计基于不同光物理机制的多种分子传感器,例如光诱导电子转移(PET)、反应转化(RT)和荧光共振能量转移(FRET);3) 针对不同类型超分辨率成像的靶向和可激活标记物的设计。以上策略设计开发的代表性应用实例如下:
2.1 硅-罗丹明染料衍生化合成方法的优化
罗丹明分子中的氨基被羟基取代,相应的母核称为荧光素染料,这是另一个非常重要的荧光染料家族。硅-罗丹明的出现立即激发了对硅-荧光素的研究,它相对于荧光素 [3] 也表现出较大的发射波长红移。类似地,先前的硅-罗丹明合成路线也适用于制备硅-荧光素衍生物,前提是羟基得到适当保护,以避免这些路线中使用的有机金属试剂引起的副反应 [4a]。有趣的是,除了硅-荧光素,还有另一种获得硅-罗丹明的重要方法,如图3所示,将羟基转化为三氟甲基磺酸盐,然后与胺偶联 [5]。虽然这是一种迂回的方法,但它的优点在于可以引入各种官能团取代的胺。
基于前期工作,具有不同类型氨基的硅-罗丹明染料已经被开发出来,它们在远红外光到NIR光谱区域表现出波长可调的荧光发射。同样重要的是,一些官能团,如羧基、叠氮化物等,可以被引入到硅-罗丹明核上的不同位点,这将有助于最终应用的进一步衍生化,包括标记、传感或组装等。

图3. 基于硅基荧光素间接合成硅基罗丹明的路线
也有硅-罗丹明染料的合成是颠倒顺序的,像Lavis等人所报道 [4b],如图4所示,首先是利用3-溴二烷基苯胺形成关键中间体二苯基硅烷衍生物,之后经过溴化,金属化,最后通过酰化亲电基团的添加产生Si-罗丹明染料,并利用该系列染料成功标记到生物分子中,实验结果也表明了Si-罗丹明染料具有出色的光稳定性和成像能力。

图4. 基于二苯基硅烷衍生物合成硅基罗丹明路线和细胞荧光成像图
2.2 基于硅-罗丹明母体的PET型探针
东京大学Nagano教授团队是将硅-罗丹明引入荧光传感的关键推动者 [6]。他们通过密度泛函理论(DFT)计算分析硅-罗丹明的LUMO和HOMO轨道能量,推断该荧光团可以作为设计基于PET(光诱导电子转移 [7])机制探针的荧光母体。因此,他们在硅-罗丹明共轭的苯单元上引入给电子取代基,从而构建了一系列对目标分析物具有典型“turn-on”荧光响应的PET分子探针。这些早期的探针主要用于检测在生物系统中具有活性的金属离子。例如,Hanaoka等人开发了基于PET机理的Ca2 探针,即CaTM-1(图5)[8]。在CaTM-1中,BAPTA部分作为标准Ca2 螯合剂,同时作为有效的电子供体,直接共价连接在硅-罗丹明荧光团的内消旋位。BAPTA是一种多齿配体,以两个邻氨基苯酚为核心,四个羧基为支链。如图4所示,所有这些组分共同参与和Ca2 的特定螯合。由于BAPTA中邻氨基酚基团的强给电子能力,CaTM-1 的远红外荧光被PET作用完全猝灭。识别Ca2 后生成的螯合物有效地消除了PET,并产生了超过1000倍的荧光增强,Kd值为0.58 μM。最后,作者用CaTM-2 AM成功观察到神经元胞体内动作电位介导的Ca2 增加。

图5. 基于硅-罗丹明设计的钙离子特异性探针。左图:红色荧光钙离子探针CaTM-1、CaTM-2和CaTM-2 AM(CaTM-2的细胞渗透性衍生物)的化学结构。右图:不含Ca2 和含Ca2 的CaTM-2水溶液的照片和海拉细胞成像图。
目前,多种基于硅-罗丹明的探针已被开发出来以检测不同类型的活性物质,如活性氧(ROS),它们在细胞生理和病理过程中发挥着关键作用。例如,Majima等人报道了另一种硅-罗丹明探针Si-DMA,其中二甲基蒽(DMA)部分作为电子供体 [9]。DMA能有效捕获光动力治疗中常见的活性物质-单线态氧。当单线态氧将DMA氧化成DMEP时,荧光量子产率从Si-DMA的0.01提高到Si-DMEP的0.20。借助Si-DMA,首次实现了PDT过程中产生的单线态氧的荧光可视化,并具有单个线粒体微管的空间分辨率(图6)。
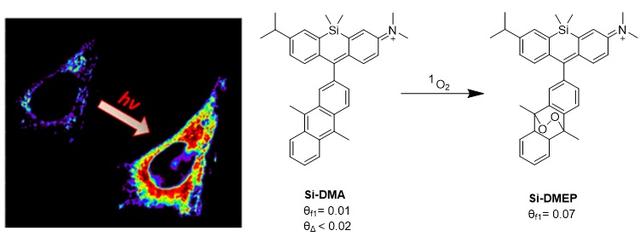
图6. 基于硅-罗丹明的单线态氧探针Si-DMA
2.3 基于硅-罗丹明母体的RT型探针
与PET类似,另一个常见的设计概念是反应转化(RT)机制。这里的反应转化是指特殊设计的探针和相应分析物之间基于特定化学反应的识别,导致了从初始到另一个不同荧光团的结构转变。由于硅-罗丹明染料具有多个可修饰位点,它们为开发RT探针提供了很好的机会。
作为一种RT类型,特殊设计的荧光底物的酶转化对于原位检测酶活性和实现酶在生物系统中的分布可视化非常有用。例如,Hanaoka和Urano等人开发了一种不对称硅-罗丹明化合物,即图7中所示的azoSiR640,用于体内乏氧成像,因为乏氧与实体肿瘤中过度表达和激活的还原酶密切相关 [10]。探针azoSiR640是非荧光的,因为硅-罗丹明核上的一个氨基改性为偶氮基。该偶氮基团很容易被还原酶还原为氨基,然后恢复具有强远红外发射的硅-罗丹明荧光团(2,6-二聚体SiR640)。azoSiR640首次应用于含有各种还原酶的大鼠肝微粒体的分析。在还原酶激活的乏氧条件下,检测到azoSiR640的荧光增强43倍。相比之下,在常氧条件下没有观察到明显的变化。然后,azoSiR640被成功地用于通过控制不同氧含量处理的活A549细胞中的乏氧成像。最后,用azoSiR640对小鼠缺氧缺血模型进行体内成像(图7)。

图7. 探针azoSiR640在体内/体外对乏氧的识别
3. 基于硅-罗丹明的超分辨成像
超分辨荧光显微镜通过超越传统光的衍射极限,实现对细胞精细结构功能的可视化,已成为国际前沿科学研究领域的一个新热点。由于硅-罗丹明的优异性能,近年来已经发表了大量关于这种新型荧光团应用的研究。2013年,约翰逊的团队首次将硅-罗丹明染料引入了超分辨成像 [11] 领域(图8),并证明了硅-罗丹明在SMLM(单分子定位显微镜 [12])和STED(受激辐射损耗显微镜 [13])型成像技术中的适用性。此后,这类荧光团在超分辨成像中越来越受欢迎。为了满足不同超分辨成像技术的高要求,研究者们已经做出了大量努力,以确保硅-罗丹明基探针的标记特异性,并加强其光物理性质,例如亮度、光稳定性和光活化等;并将SiR-SNAP、SiR-CLIP和SiR-Halo应用于活细胞成像,部分SiR-羧基衍生物可与蛋白质标签偶联产生荧光两性离子,剩余未反应染料可聚集或与疏水表面的非特异性蛋白结合形成非荧光螺内酯,成功证明SiR标记的蛋白质在多色成像中是具有潜力的。
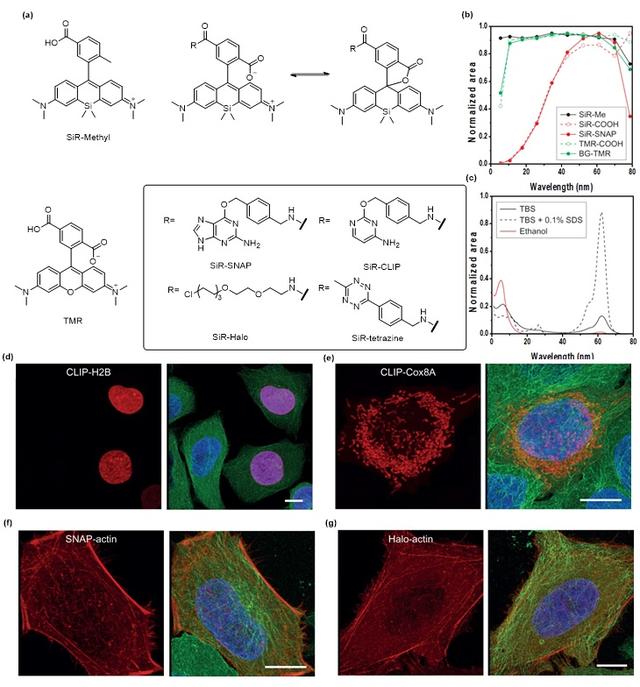
图8. (a) SiR染料的结构、TMR和SiR羧基螺环内酯的形成。(b) 水-二氧六环混合物中SiR和TMR衍生物两性离子区吸收光谱的归一化积分作为介电常数的函数。注意,ɛ = 80(0%的二氧六环)处的吸光度受荧光团聚集的影响。BG-TMR表示耦合到BG的TMR。(c) 2.5 µM SiR SNAP的吸收光谱在乙醇(红色实线)、Tris缓冲盐水(TBS)缓冲液(带(黑色虚线)和不带(黑色实线)0.1%十二烷基硫酸钠(SDS)中测量。(d-g) SiR-羧基衍生物对活细胞成像的适用性实验(SiR-SNAP,SiR-CLIP和SiR-Halo)。
4. 元素取代策略的扩展
受硅-罗丹明染料的优良性能和巨大潜力的启发,采用相同的元素替换策略,研究者建立了一些新型的长波长染料家族。首先,考虑到荧光素染料与罗丹明在结构上的相似性,类比硅-罗丹明,人们开始开发硅-荧光素荧光染料,这个想法由日本科学家Nagano团队开始实施 [3]。与荧光素相比,硅-荧光素的吸收光谱和发射光谱发生了显著红移(约90 nm)。长波长硅-荧光素也有重要的应用,例如,Nagano等人使用它设计了一种用于评估β-半乳糖苷酶活性的探针 [3],以及一种用于检测钙离子的探针 [14],McCarroll等人使用它设计了一种用于检测次氯酸的荧光探针 [4],Bertozzi等人使用它结合点击反应设计了一种用于特定标记的探针[15],等等。
其次,由于硅元素具有如此显著的光谱调谐效应,人们研究将硅元素替换为第四主族[16a] 中的其它元素的染料改造方式和光谱性能变化。Nagano等人开发了含锗或锡的罗丹明、GeR和SnR,以与硅对应物SiR进行比较。虽然SnR不稳定,但GeR得到了有效地合成和表征。GeR的吸收和发射最大值分别为635 nm和649 nm,均比SiR小约15 nm。GeR的荧光量子产率为0.34,与SiR相当。因此,GeR也是一种很有前途的长波长染料,最近Urano等人 [16b]将其应用于设计一种检测pH值的近红外探针HMGeR,并成功应用到由内吞作用引起的细胞荧光成像中,实验将 150 nM 的偶联物加载到 NIR3T3/HER2( )小鼠成纤维细胞中,24 h后可观察到强荧光出现,结果表明 Her-HMIGeR 通过 HER2 被内吞作用内化,然后在进入酸性溶酶体时发出荧光(图9),Zhang等人将其应用于监测细胞氧化还原自我调节的传感器 [17]。

图9. 锗基-罗丹明探针用于检测pH值
除第四主族外,其它族中元素的取代效应也具有潜在吸引力。一个有趣的例子是Wang等人[18] 在2015年报道的磷取代罗丹明。取代富电子三价膦,使用吸电子的氧化膦来稳定LUMO轨道能量。所得PO-罗丹明PR比Si-罗丹明表现出近40 nm的红移,其发射光谱红移到700 nm以上(图10),成功将该探针应用到活的 HepG2 细胞和正常小鼠的染色中,无需任何进一步修饰即可轻松加载到活细胞中,证实了与母体罗丹明相似的膜渗透性,在小鼠肌内注射tMe-PR 48 h后仍然可获得较强的荧光图,证实探针易于穿透组织和信噪比高。元素取代的另一种情况是硫取代罗丹明。虽然在染料化学史上,第六主族中的硫元素曾被用来取代罗丹明的氧,而S-罗丹明类似物由于S和O的相似性没有显示出明显的光谱位移。但是,郭炜等人 [19] 发现,当硫原子被氧化成砜时,生成的SO2-罗丹明,即SO2R,表现出比硅-罗丹明更明显的红移。SO2R衍生物的吸收和发射最大值分别达到700–710 nm和728–752 nm。基于这些发现,可以得出结论,用缺电子基团替换10号位上的氧将导致明显的荧光发射红移,这为长波长罗丹明类似物的发展提供了指导思想,也为设计化学传感器提供了许多新的机会。

图10. 在pH 7.4条件下,Me或Me-SiR的吸收和发射光谱以及PBS中的PRs;HepG2 细胞成像和小鼠时间依赖性实验荧光图像。
5. 展望:长波长染料应用前景
硅-罗丹明荧光探料作为一种新兴的具有高亮度和光稳定性的长波长荧光团,成功开发用于监测不同种类物质的化学传感器或超分辨成像标记的多功能光学平台,在生命科学中显示了诸多有趣和重要的应用。基于上述元素取代策略的成功探索,其他元素替代的高性能染料类型得以进一步开发,并被证明是有效的长波长荧光染料开发策略。由于生命科学领域精准可视化、原位检测的需求,需要开发大量在不同光谱区域发光的高性能荧光染料和分子探针,尤其是长波长染料的开发和应用将是一个长期的热点领域。
目前,近红外二区NIR II(900–1100 nm)区域的活体荧光成像和光疗研究越来越多,因为在这个生物窗口中,光子具有更强的组织穿透能力。硅-罗丹明以及其他几种元素替代的罗丹明染料在临床应用上被寄予厚望,但它们的吸收/发射还不能满足这样的要求 [20]。杨有军等将两个额外的苯环结合到罗丹明的骨架中,成功地将荧光发射波长最大值红移到NIR II [21],这为解决上述问题提供新思路。事实上,通过扩展络合骨架的策略开发的NIR II荧光染料依然很少,充分利用元素取代罗丹明的设计和拓展方法,未来仍有很大的空间来优化已报道的NIR II染料的光物理、化学和生物性能,为进一步的临床医学应用奠定良好的基础。
总之,在生命科学中,用硅取代罗丹明上的氧桥是荧光染料发展道路上的一个里程碑,不仅长波长硅-罗丹明衍生物已被开发为多种用途的化学、生物材料,而且硅取代的开创性概念已被推广为设计新型长波长染料的重要元素替代思想。在未来,这一策略有望继续指导产生更多的功能染料分子,为生物医学研究提供强有力工具。
参考文献:
[1] M. Fu, Y. Xiao, X. Qian, D. Zhao, Y. Xu, Chem. Commun. (2008) 1780–1782.
[2] Y. Xiao, X. Qian, Coord. Chem. Rev. 423 (2020) 213513.
[3] T. Egawa, Y. Koide, K. Hanaoka, T. Komatsu, T. Teraiab, T. Nagano, Chem. Commun. 47 (2011) 4162–4164.
[4] (a) Q.A. Best, N. Sattenapally, D.J. Dyer, C.N. Scott, M.E. McCarroll, J. Am. Chem. Soc. 135 (2013) 13365–13370. (b) Jonathan B. Grimm, Timothy A. Brown, Ariana N. Tkachuk, and Luke D. Lavis. ACS Cent. Sci. 3 (2017) 975–985
[5] A.N. Butkevich, V.N. Belov, K. Kolmakov, V.V. Sokolov, H. Shojaei, S.C. Sidenstein, D. Kamin, J. Matthias, R. Vlijm, J. Engelhardt, S.W. Hell, Chem. Eur. J. 23 (2017) 12114–12119.
[6] Y. Kushida, T. Nagano, K. Hanaoka, Analyst 140 (2015) 685–695.
[7] A.P. de Silva, H.Q.N. Gunaratne, T. Gunnlaugsson, A.J.M. Huxley, C.P. McCoy, J.T. Rademacher, T.E. Rice, Chem. Rev. 97 (1997) 1515–1566.
[8] T. Egawa, K. Hirabayashi, Y. Koide, C. Kobayashi, N. Takahashi, T. Mineno, T. Terai, T. Ueno, T. Komatsu, Y. Ikegaya, N. Matsuki, T. Nagano, K. Hanaoka, Angew. Chem. Int. Ed. 52 (2013) 3874–3877.
[9] S. Kim, T. Tachikawa, M. Fujitsuka, T. Majima, J. Am. Chem. Soc.136 (2014) 11707–11715.
[10] K. Hanaoka, Y. Kagami, W. Piao, T. Myochin, K. Numasawa, Y. Kuriki, T. Ikeno, T.Ueno, T. Komatsu, T. Terai, T. Nagano, Y. Urano, Chem. Commun. 54 (2018) 6939–6942.
[11] G. Lukinavicˇius, K. Umezawa, N. Olivier, A. Honigmann, G. Yang, T. Plass, V. Mueller, L. Reymond, I.R. Corrêa Jr, Z. Luo, C. Schultz, E.A. Lemke, P. Heppenstall, C. Eggeling, S. Manley, K. Johnsson, Nat. Chem. 5 (2013) 132–139.
[12] M. Bates, B. Huang, G.T. Dempsey, X.W. Zhuang, Science 317 (2007) 1749–1753.
[13] S.W. Hell, J. Wichmann, Opt. Lett.19 (1994) 780–782.
[14] T. Egawa, K. Hirabayashi, Y. Koide, C. Kobayashi, N. Takahashi, T. Mineno, T. Terai, T. Ueno, T. Komatsu, Y. Ikegaya, N. Matsuki, T. Nagano, K. Hanaoka, Angew. Chem. Int. Ed. 52 (2013) 3874–3877.
[15] P. Shieh, V.T. Dien, B.J. Beahm, J.M. Castellano, T. Wyss-Coray, C.R. Bertozzi, J. Am. Chem. Soc. 137 (2015) 7145–7151.
[16] (a) K. Yuichiro, Y. Urano, K. Hanaoka, T. Terai, T. Nagano, ACS Chem. Biol. 6 (2011) 600–608. (b) Y. Koide, R. Kojima, K. Hanaoka, K. Numasawa, T. Komatsu, T. Nagano, H. Kobayashi, Y. Urano, Chem. Commun. 2 (2019) 94.
[17] H. Nie, J. Jing, Y. Tian, W. Yang, R. Zhang, X. Zhang, ACS Appl. Mater. Interfaces 8 (2016) 8991–8997.
[18] X. Chai, X. Cui, B. Wang, F. Yang, Y. Cai, Q. Wu, T. Wang, Chem. Eur. J. 21 (2015) 16754–16758.
[19] J. Liu, Y. Sun, H. Zhang, H. Shi, Y. Shi, W. Guo, ACS Appl. Mater. Interfaces 8 (2016) 22953–22962.
[20] A. R. Montaño, L. G. Wang, C. W. Barth, N. A. Shams, K. A. S.U. Kumarapeli, S. L. Gibbs, In Vivo Nerve-Specificity of Rhodamines and Si-rhodamines, in: S. Gioux, S. L. Gibbs, B. W. Pogue (eds.) Proc. of SPIE 11222 (2020) 112220I.
[21] X. Luo, J. Li, J. Zhao, L. Gu, X. Qian, Y. Yang, Chin. Chem. Lett. 30 (2019) 839–846.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






