急性肝损伤与蛋白组学综述(熊建萍教授组稿)

主编按语·熊建萍教授
在临床真实世界对医师最有启发意义的就是病例分享,面对千变万化的病人如果能够抓住临床诊治的核心,那么万变不离其宗,病人是否获得良好的长期生存,往往就在医师的一个关键选择,因此作为肿瘤临床医师不断学习最新知识,不断总结临床经验,用心细致分析病情变化极为重要。我们消化肿瘤团队病床数达到200张,每年收治消化肿瘤1500人次,为我省消化肿瘤病人解除病痛努力拚博,获得广泛好评。本期病例分享,青年医师不约而同选择了自己行医历程中印象深刻的,给病人带来较好疗效的成功病例,我们看到从掌握基础知识出发,推理临床实践和应用,在多线治疗病情仍然进展危害病人生命时,尽可能根据精准医学指导,选择最新的免疫治疗或靶向治疗,使病人峰回路转柳暗花明重获新生。
本期执行主编

熊建萍 教授
南昌大学第一附属医院肿瘤科主任医师、二级教授、博士生导师
江西省政府特殊津贴获得专家
中华医学会肿瘤分会委员
中国女医师协会临床肿瘤分会常委
中国抗癌协会支持治疗专业委员会常委/化疗专业委员会常委/肺癌专委会常委
中国肿瘤临床学会理事
第二期
熊建萍教授力荐:《一例同时合并dMMR和EGFR“敏感”突变的肝细胞癌患者对EGFR-TKI治疗无反应的病例报道》
本文作者:南昌大学第一附属医院黄姗姗 黎军和 项晓军 熊建萍

黎军和 副教授
南昌大学第一附属医院肿瘤医学中心副主任主任医师、副教授、博士研究生导师
中国抗癌协会癌症姑息与康复专业委员会委员
中国抗癌协会CMUP专业委员会委员

黄姗姗
南昌大学第一附属医院肿瘤科医师、主治医师、博士
以第一作者发表SCI论文6篇,累积IF>20分
主持江西省自然科学基金1项,省卫健委基金1项
留学归国人员、新加坡科技研究局(A*STAR)访问学者
正文如下
摘要
表皮生长因子受体 (EGFR) 酪氨酸激酶抑制剂 (TKIs) 在全球范围内被批准用于治疗 EGFR 突变阳性的晚期非小细胞肺癌(NSCLC)患者。然而,使用EGFR TKIs治疗NSCLC以外的其他EGFR突变阳性恶性肿瘤的报道并不多。在此,我们报告了一例合并错配修复蛋白缺失(dMMR) 和 EGFR 19号外显子缺失的原发性肝细胞癌 (HCC)患者,该患者接受了第一代 EGFR-TKI(吉非替尼)治疗。然而,吉非替尼治疗1个月后,患者病情恶化。此后,他又接受了免疫检查点抑制剂治疗,获得了很好的治疗效果。至今,该患者在过去的21个月内都没有观察到疾病进展的迹象。本病例表明EGFR不是HCC的驱动基因,EGFR TKI对具有EGFR“敏感”突变的HCC患者无效。
前言
肝癌是最常见的消化系统恶性肿瘤之一,也是全球癌症相关死亡的第三大原因[1]。中国每年新增病例超过 373,000 例,占全球发病率的近一半[2]。肝癌主要包括两种组织学亚型:肝细胞癌(HCC)和肝内胆管癌(ICC)[3]。一般来说,70%-75%的肝癌是HCC。HCC的主要危险因素包括慢性乙型肝炎(HBV)和丙型肝炎病毒(HCV)感染、肝硬化、过量饮酒等[4]。由于缺乏特异性症状,大多数HCC患者诊断时已为晚期,失去了接受根治性肝切除术的机会[5]。因此,姑息性系统治疗对于晚期HCC患者具有重要意义。
目前,索拉非尼、瑞戈非尼和仑伐替尼已被批准用于晚期HCC的一线或二线治疗[6]。由于治疗选择有限,晚期HCC患者的总体生存获益相当局限。最近,免疫疗法已在各种恶性肿瘤中展现出治疗潜能[7-9]。
表皮生长因子受体(EGFR)是实体癌中最常发生改变的癌基因之一[10]。EGFR激酶激活突变和EGFR蛋白过表达是EGFR基因在肿瘤中的两大主要改变方式[11],这些改变均可导致EGFR信号异常激活。EGFR及其下游基因的异常激活可促进包括细胞增殖、迁移和血管新生等多项生物进程[12]。目前,一些针对肿瘤患者EGFR异常改变的措施已经发展起来,例如酪氨酸激酶抑制剂(TKI)。EGFR TKIs已被推荐作为EGFR突变阳性晚期NSCLC患者的一线治疗。然而,使用EGFR TKIs治疗NSCLC以外的其他EGFR突变阳性恶性肿瘤的报道并不多。我们在此报道一例合并EGFR 19外显子缺失突变的原发性肝细胞癌,并接受了第一代EGFR-TKI(吉非替尼)治疗。
病例介绍
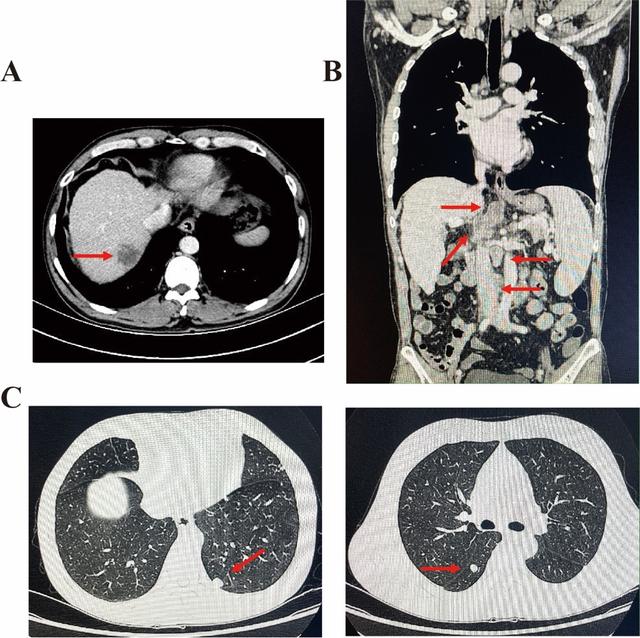
一名 53 岁男性,既往有慢性乙型肝炎感染病史> 20 年。2019-10-07体检时行胸部CT平扫结果提示肺转移性肿瘤可能。为明确诊断,于2019-10-10至我院门诊行胸全腹部CT(平扫 增强)结果示:1、肝右叶肿块,考虑原发性肝CA,并腹膜后多发淋巴结转移;2、肝硬化,脾大。3、两肺多发结节,考虑转移瘤(图1)。
2019-10-22我院左肺穿刺物病理结果:(左肺穿刺物)低分化癌,首先考虑转移性癌,免疫组化结果如下:CK7(3 ); CK20(-); Villin(3 ); Hep(-); Galectin-3(3 ); CK19(2 ); TTF-1(-); NapsinA(-); P40(-); P63(-); Ki-67(30% ); HSP70( );Gly(-); CD56(-); Syn(弱 ); CgA(-); P504S(-); PSA(-)。基于以上检查结果,该患者诊断为IV期HCC,伴有肺转移和腹膜后淋巴结转移。此外,该患者还接受了二代测序(NGS)检测,结果显示该患者具有EGFR“敏感”突变,p.E746_A750del in exon 19 (VAF: 16.36%)。我们还对患者肺部穿刺物加做了四种错配修复蛋白的免疫组化,结果显示MLH1(-),PMS2(-),MSH2( ),MSH6( )。该患者的一线治疗方案改如何选择?EGFR TKI 还是免疫检查点抑制剂?基于前人在NSCLC中得出的一些经验,EGFR 突变型肺癌患者对免疫检查点抑制剂治疗反应不佳[13-15]。一部分EGFR突变患者在接受免疫治疗后甚至表现出肿瘤超进展[16,17]。因此,我们首先建议患者口服吉非替尼(250mg,qd)。然而,在治疗1个月后,患者胸腹部CT显示肝脏肿块以及腹膜后淋巴结和肺转移灶扩大(图2)。
当时,批准用于 HCC 的一线药物是索拉非尼、仑伐替尼或全身化疗。免疫检查点抑制剂在2019年NCCN指南中仅仅推荐为二线用药。然而,我们考虑到患者错配修复蛋白表达缺失,这提示患者如若接受免疫治疗可能取得不错疗效。于是我们后续决定使用免疫治疗(卡瑞丽珠单抗 200mg D1/q3w)作为该患者的治疗方案。令人惊讶的是,在两个周期的治疗后,CT 扫描显示与基线相比,肝脏肿块、腹膜后淋巴结、肺转移灶显著缩小(图 2)。至今为止,患者总生存时间已超过21个月。
讨论
在NSCLC中,EGFR的酪氨酸激酶活性失调可导致恶性细胞增殖、侵袭和转移增加。使用EGFR-TKIs 治疗可在携带EGFR突变的 NSCLC 患者中产生显著的抗肿瘤活性[18,19]。最常见的致敏突变是EGFR 19外显子缺失突变和21外显子L858R点突变,占EGFR突变类型的90%[20]。虽然EGFR在肺癌中的突变率最高[21],但EGFR突变也存在于其他恶性肿瘤中,例如:常规多形性胶质母细胞瘤、胶质母细胞瘤、结肠癌等(图3)。
有II期临床研究表明,吉非替尼或厄洛替尼在食管癌患者中的总体客观缓解率为8.8%[22-23]。在另一项II期临床研究中,80名胃癌患者未表现出对EGFR TKI的治疗反应[24,25 ]。我们不禁想知道EGFR TKI是否对携带EGFR“敏感”突变的肝细胞癌有效?
免疫疗法已经改变了许多晚期癌症的治疗方法。然而,对于携带EGFR 突变和ALK重排的NSCLC患者,免疫治疗却未能带来任何益处[26,27]。CheckMate 012[28] 是一项I期研究,评估了nivolumab单药/联合方案作为晚期 NSCLC 的一线治疗的疗效。与 EGFR 野生型组相比,在单药治疗队列的 EGFR 突变亚组中显示出较低的缓解率和较低的生存获益。(ORR分别为 14%和30%;中位PFS,分别为1.8和6.6个月)。此外,在一项II期研究中,该研究调查了pembrolizumab在未接受过TKI治疗的EGFR 突变、PD-L1阳性的晚期NSCLC患者中的疗效。在入组的11名患者中均未观察到肿瘤退缩[29]。此外研究者还表明 EGFR 突变可能作为晚期 NSCLC 患者接受免疫治疗药物出现肿瘤超进展的预测因子[16]。因此,我们首先建议患者每天服用250mg吉非替尼进行一线靶向治疗。然而,该患者在服用吉非替尼1个月后出现疾病进展。
在西方国家大约 15% 的肺腺癌中可检测到 EGFR 突变,在亚洲、女性、从不吸烟或轻度吸烟的患者中这一比例更高[30,31]。然而,在 HCC 中,EGFR突变的数据有限。早先有两项研究报告称,HCC中未检测到EGFR突变[32,33]。然而,随着更灵敏的测序技术的出现,随后的研究报道分别在13/33(39.4%)和11/33(33.3%)的HCC组织中检测到EGFR突变[34]。值得注意的是,大多数报道的突变属于罕见突变,并且未检测到 EGFR 突变与 EGFR 过表达、Ki-67、肿瘤大小和其他临床参数之间的显着关联。因此,我们推测EGFR不是HCC的驱动基因,这可能可以解释为什么该患者与对吉非替尼治疗的反应不佳。当然,还需要大样本研究来验证我们的推测。
由于错配修复蛋白缺失的肿瘤患者对免疫治疗的高敏感性[35]。此后,我们决定使用免疫治疗(卡瑞丽珠单抗 200mg D1/q3w)作为患者的后续治疗。短短两个疗程后,我们在肝脏病变和肺转移灶中观察到肿瘤消退现象。从最初使用卡瑞利珠单抗到现在,患者肿瘤控制稳定,目前已定期接受免疫治疗 21 个月。
黎军和、熊建萍点评
(1)该患者为一例合并MSI-H 和 EGFR 19号外显子缺失的原发性肝癌(HCC),对吉非替尼治疗耐药,而对PD-1抑制剂敏感。虽然60-85%HCC存在EGFR过表达,但EGFR突变发生率低,Su等采用直接测序的方法检测了89例HCC患者EGFR 18-21外显子突变,无1例患者检测出可能导致氨基酸改变/缺失的突变;此外,HCC中EGFR突变可能并非如肺腺癌中那样作为驱动基因突变,Sueangoen发现HCC患者EGFR突变并不能导致持续的酪氨酸激酶活化,其激酶活性仍然部分依赖于细胞外EGF,在体外试验中发现EGFR突变HCC细胞均对厄洛替尼耐药,即使高浓度厄洛替尼亦仅能部分抑制或不能抑制EGFR及AKT、ERK磷酸化及细胞凋亡和自噬,这可以部分解释该患者虽然携带EGFR19号外显子突变,但对吉非替尼治疗无效。
(2)HCC患者MSI-H比例明显低于结直肠癌,一项研究连续检测了82例HCC组织,仅2例为MSI-H患者。近来有研究发现MSI-H胃肠道肿瘤更容易并存其他基因改变如BRAF、EGFR、Ⅱ型TGF-β突变等,如Gokare等发现MSI-H结直肠癌患者45%在EGFR受体激酶区(RTK)存在突变。该患者对PD-1抑制剂反应良好,再次验证了MSI-H作为PD-1抑制剂疗效预测的生物标记物的价值,当前,基于Imbrave-150、Orient-032及KEYNOTE-524研究结果,免疫靶向联合在HCC一线治疗价值的循证医学证据越来越强,该患者采用免疫靶向联合治疗策略也值得尝试。
参考文献
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018, 68(6):394-424.
2. Zheng R, Qu C, Zhang S, Zeng H, Sun K, Gu X, Xia C, Yang Z, Li H, Wei W et al: Liver cancer incidence and mortality in China: Temporal trends and projections to 2030. Chin J Cancer Res 2018, 30(6):571-579.
3. Chaisaingmongkol J, Budhu A, Dang H, Rabibhadana S, Pupacdi B, Kwon SM, Forgues M, Pomyen Y, Bhudhisawasdi V, Lertprasertsuke N et al: Common Molecular Subtypes Among Asian Hepatocellular Carcinoma and Cholangiocarcinoma. Cancer Cell 2017, 32(1):57-70 e53.
4. Giannini EG, Aglitti A, Borzio M, Gambato M, Guarino M, Iavarone M, Lai Q, Levi Sandri GB, Melandro F, Morisco F et al: Overview of Immune Checkpoint Inhibitors Therapy for Hepatocellular Carcinoma, and The ITA.LI.CA Cohort Derived Estimate of Amenability Rate to Immune Checkpoint Inhibitors in Clinical Practice. Cancers (Basel) 2019, 11(11).
5. Liu Z, Lin Y, Zhang J, Zhang Y, Li Y, Liu Z, Li Q, Luo M, Liang R, Ye J: Molecular targeted and immune checkpoint therapy for advanced hepatocellular carcinoma. J Exp Clin Cancer Res 2019, 38(1):447.
6. Dhanasekaran R, Nault JC, Roberts LR, Zucman-Rossi J: Genomic Medicine and Implications for Hepatocellular Carcinoma Prevention and Therapy. Gastroenterology 2019, 156(2):492-509.
7. El-Khoueiry AB, Sangro B, Yau T, Crocenzi TS, Kudo M, Hsu C, Kim TY, Choo SP, Trojan J, Welling THR et al: Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet 2017, 389(10088):2492-2502.
8. Zhu AX, Finn RS, Edeline J, Cattan S, Ogasawara S, Palmer D, Verslype C, Zagonel V, Fartoux L, Vogel A et al: Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. Lancet Oncol 2018, 19(7):940-952.
9. Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Kudo M, Breder V, Merle P, Kaseb AO et al: Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med 2020, 382(20):1894-1905.
10. Yarden Y, Pines G: The ERBB network: at last, cancer therapy meets systems biology. Nat Rev Cancer 2012, 12(8):553-563.
11. Thomas R, Weihua Z: Rethink of EGFR in Cancer With Its Kinase Independent Function on Board. Front Oncol 2019, 9:800.
12. Nan X, Xie C, Yu X, Liu J: EGFR TKI as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer. Oncotarget 2017, 8(43):75712-75726.
13. Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, Chow LQ, Vokes EE, Felip E, Holgado E et al: Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015, 373(17):1627-1639.
14. Herbst RS, Baas P, Kim DW, Felip E, Perez-Gracia JL, Han JY, Molina J, Kim JH, Arvis CD, Ahn MJ et al: Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016, 387(10027):1540-1550.
15. Rittmeyer A, Barlesi F, Waterkamp D, Park K, Ciardiello F, von Pawel J, Gadgeel SM, Hida T, Kowalski DM, Dols MC et al: Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017, 389(10066):255-265.
16. Kato S, Goodman A, Walavalkar V, Barkauskas DA, Sharabi A, Kurzrock R: Hyperprogressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate. Clin Cancer Res 2017, 23(15):4242-4250.
17. Huang X, Xia L, Lan F, Shao YW, Li W, Xia Y: Treatment of Nivolumab Results in Hyperprogressive Disease in a Patient Harboring EGFR Exon 20 Insertion and MYC Amplification. J Thorac Oncol 2019, 14(9):e189-e191.
18. Gazdar AF: Activating and resistance mutations of EGFR in non-small-cell lung cancer: role in clinical response to EGFR tyrosine kinase inhibitors. Oncogene 2009, 28 Suppl 1:S24-31.
19. Qiu X, Yuan H, Sima B: Relationship between EGFR mutation and computed tomography characteristics of the lung in patients with lung adenocarcinoma. Thorac Cancer 2019, 10(2):170-174.
20. Fruh M, Peters S: EGFR mutation subtype impacts efficacy of immune checkpoint inhibitors in non-small-cell lung cancer. Ann Oncol 2019, 30(8):1190-1192.
21. Consortium APG: AACR Project GENIE: Powering Precision Medicine through an International Consortium. Cancer Discov 2017, 7(8):818-831.
22. Ferry DR, Anderson M, Beddard K, Tomlinson S, Atherfold P, Obszynska J, Harrison R, Jankowski J: A phase II study of gefitinib monotherapy in advanced esophageal adenocarcinoma: evidence of gene expression, cellular, and clinical response. Clin Cancer Res 2007, 13(19):5869-5875.
23. Thallinger CM, Raderer M, Hejna M: Esophageal cancer: a critical evaluation of systemic second-line therapy. J Clin Oncol 2011, 29(35):4709-4714.
24. Dragovich T, McCoy S, Fenoglio-Preiser CM, Wang J, Benedetti JK, Baker AF, Hackett CB, Urba SG, Zaner KS, Blanke CD et al: Phase II trial of erlotinib in gastroesophageal junction and gastric adenocarcinomas: SWOG 0127. J Clin Oncol 2006, 24(30):4922-4927.
25. Rojo F, Tabernero J, Albanell J, Van Cutsem E, Ohtsu A, Doi T, Koizumi W, Shirao K, Takiuchi H, Ramon y Cajal S et al: Pharmacodynamic studies of gefitinib in tumor biopsy specimens from patients with advanced gastric carcinoma. J Clin Oncol 2006, 24(26):4309-4316.
26. Gainor JF, Shaw AT, Sequist LV, Fu X, Azzoli CG, Piotrowska Z, Huynh TG, Zhao L, Fulton L, Schultz KR et al: EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non-Small Cell Lung Cancer: A Retrospective Analysis. Clin Cancer Res 2016, 22(18):4585-4593.
27. Lee CK, Man J, Lord S, Links M, Gebski V, Mok T, Yang JC: Checkpoint Inhibitors in Metastatic EGFR-Mutated Non-Small Cell Lung Cancer-A Meta-Analysis. J Thorac Oncol 2017, 12(2):403-407.
28. Gettinger S, Rizvi NA, Chow LQ, Borghaei H, Brahmer J, Ready N, Gerber DE, Shepherd FA, Antonia S, Goldman JW et al: Nivolumab Monotherapy for First-Line Treatment of Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2016, 34(25):2980-2987.
29. Lisberg A, Cummings A, Goldman JW, Bornazyan K, Reese N, Wang T, Coluzzi P, Ledezma B, Mendenhall M, Hunt J et al: A Phase II Study of Pembrolizumab in EGFR-Mutant, PD-L1 , Tyrosine Kinase Inhibitor Naive Patients With Advanced NSCLC. J Thorac Oncol 2018, 13(8):1138-1145.
30. Rosell R, Moran T, Queralt C, Porta R, Cardenal F, Camps C, Majem M, Lopez-Vivanco G, Isla D, Provencio M et al: Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med 2009, 361(10):958-967.
31. Hirsch FR, Bunn PA, Jr.: EGFR testing in lung cancer is ready for prime time. Lancet Oncol 2009, 10(5):432-433.
32. Su MC, Lien HC, Jeng YM: Absence of epidermal growth factor receptor exon 18-21 mutation in hepatocellular carcinoma. Cancer Lett 2005, 224(1):117-121.
33. Lee SC, Lim SG, Soo R, Hsieh WS, Guo JY, Putti T, Tao Q, Soong R, Goh BC: Lack of somatic mutations in EGFR tyrosine kinase domain in hepatocellular and nasopharyngeal carcinoma. Pharmacogenet Genomics 2006, 16(1):73-74.
34. Panvichian R, Tantiwetrueangdet A, Sornmayura P, Leelaudomlipi S: Missense Mutations in Exons 18-24 of EGFR in Hepatocellular Carcinoma Tissues. Biomed Res Int 2015, 2015:171845.
35. Le DT, Durham JN, Smith KN, Wang H, Bartlett BR, Aulakh LK, Lu S, Kemberling H, Wilt C, Luber BS et al: Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017, 357(6349):409-413.
未完待续
敬请期待 · 第三期
版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:医悦汇”。
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com