复方甘草酸苷片对肝损伤疗效(甘草水煎液对-萘异硫氰酸酯诱导的肝内胆汁淤积性损伤的防治及其机理研究)
精品文章
本课题拟采用ANIT诱导IC模型,探讨甘草水煎液对IC模型小鼠肝损伤的防治作用及其机制,为临床使用甘草水煎液治疗IC提供依据。
甘草水煎液对α-萘异硫氰酸酯诱导的肝内胆汁淤积性损伤的防治及其机理研究
沈淑娇,张志荣,张林林,樊玉娟,谭波,李玥,蒋健,裘福荣
上海中医药大学附属曙光医院,临床药代动力学实验室,上海201203
【摘要】目的:探讨甘草水煎液对α-萘异硫氰酸酯( ANIT)所致肝内胆汁淤积症(IC)模型小鼠肝损伤的防治作用。方法:雌性C57BL/6小鼠随机分为正常组、模型组、甘草低剂量组(1. 13 g·kg-1·d-1)、甘草中剂量组(2.25 g·kg-1·d-1)及甘草高剂量组(4. 50 g·kg-1·d-1),连续给药10 d,检测总胆红素( TBIL)、谷丙转氨酶(ALT)、谷草转氨酶( AST)及碱性磷酸酶(ALP)水平,HE染色观察肝脏病理,用LC-MS/MS测定血浆胆汁酸含量,RT-PCR检测孕烷受体、细胞色素P450 3A11、尿苷二磷酸葡萄糖醛酸转移酶1A1和胆酸盐外排泵。结果:与模型组相比,甘草低、中剂量组ALT、AST和ALP有下降趋势;甘草高剂量组ALT、AST和ALP水平明显降低(P<0.05);与模型组比较,血浆CA浓度在甘草低、中、高剂量分别减少32. 2%、55. 1%和84.4%;血浆CDCA浓度在高剂量减少45. 8%;血浆DCA浓度在甘草低、中、高剂量分别减少49. 1%、52. 5%和67. 1%;血浆LCA浓度在甘草低、中、高剂量分别减少59. 5%、59. 5%和56. 7%。甘草水煎液可增加孕烷受体、细胞色素P450 3A11、尿苷二磷酸葡萄糖醛酸转移酶1A1和胆酸盐外排泵的mRNA转录(P<0.05),并呈剂量依赖性。结论:甘草水煎液可促进胆汁酸代谢和排泌,减轻胆汁酸负荷,对IC肝损伤起防治作用。
【关键词】甘草水煎液;肝内胆汁淤积症;孕烷受体;防治机制
肝内胆汁淤积症(intrahepatic cholestasis,IC)是由肝细胞及毛细胆管胆汁细胞损害,胆汁酸转运障碍,胆汁流动异常等相关机制[1][24][5-7][8-9]
1 材料与方法
1.1 药品及试剂
甘草购于上海康桥中药饮片有限公司,批号:131231,经徐德生教授确定为豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根;ANIT,批号:101458025,购于美国Sigma-Aldrich公司;肝素钠注射液(国药准字:H31022051,2mL: 12 500单位)购于上海第一生化药业有限公司;其他化学试剂(如甲醛、磷酸二氢钠、十二水磷酸氢二钠等)均为国产分析纯,购自国药集团化学试剂有限公司;实验用植物油为初榨橄榄油,实验用水为去离子水。
1.2 仪器
4000 Q-Trap LC-MS/MS系统(美国ABI/SCIEX公司),LC-20AD液相色谱(日本SHIMADZU公司),IKA-werkeTyp VX2E震荡器(德国IKA公司),Allegra 64R型低温高速离心机(美国Beckman公司),AB135-S型分析天平(瑞士METTLER公司),Direct-Q3纯水系统(美国Millipore公司)。
1.3 动物
C57BL/6小鼠,雌性,SPF级,6周龄,40只,体质量20~22g,由上海西普尔-必凯实验动物有限公司提供,许可证号:SCXK(沪)2013 -0016,在上海中医药大学实验动物中心的普通环境中饲养,并适应性饲养2周。
1.4 甘草水煎液的制备
甘草按《中国药典》2010年版一部规定的临床剂量并结合相关文献按体表面积换算成小鼠剂量,分为低、中、高3组,分别对应正常成人7.5、15、30 g/d的用量。称重后加入10倍量去离子水,浸泡60 min,加热回流2次,每次1 h,滤过后合并提取液,离心取上清并减压旋转蒸发,分别浓缩至按生药量计为0. 056、0. 113、0.225 g/mL,置于4℃冰箱,待用。制得的甘草水煎液以主要成分甘草酸进行了液相色谱定量,低、中、高剂量组甘草水煎液中甘草酸含量分别为0. 46、0.92、1.84 mg/mL。
1.5 造模药物的制备
精密称取ANIT 200 mg,溶于20 mL植物油中,充分混匀溶解制成浓度为10 mg/mL的油溶液,置于4℃冰箱,待用。
1.6 实验动物给药方案
适应性喂养1周后,将40只C57BL/6小鼠随机分为5组,分别为正常组(N)、模型组(M)、甘草低剂量组(GC-L,1.13 g·kg-1·d-1)、甘草中剂量组(GC-M,2.25g·kg-1·d-1)及甘草高剂量组( GC-H,4.50 g·kg-1·d-1)。给药阶段,每天称重并计算给药体积(0.4 mL/20g),每天1次,共10 d。其中甘草低剂量组、甘草中剂量组及甘草高剂量组药液水浴温热后灌胃给药,正常组及模型组则给予同体积生理盐水。除正常组外,其余各组于第7天、第10天在给药1h后再次给予ANIT油溶液(100 mg/kg,按0.2 mL/20 g)造模,正常组则给予等体积的空白油溶液。末次给药后,禁食不禁水,12 h后进行取材。
摘眼球取血,分装肝素抗凝管和不抗凝管,10 000 r/min离心10 min分离血浆和血清,置于- 80℃保存备用。分离肝脏,肝脏经生理盐水漂洗后,部分肝左叶切片包埋,于10%中性福尔马林溶液中固定备用,其余肝组织装入EP管于-80℃保存备用。
1.7 小鼠血清生化学检测
小鼠血清样本于37℃解冻,分别取适量体积送至上海曙光医院检验科进行总胆红素( TBIL)、谷丙转氨酶(ALT)、谷草转氨酶( AST)及碱性磷酸酶(ALP)的检测。
1.8 肝脏病理形态学观察
肝脏病理切片制备及HE染色均由上海中医药大学组织病理实验室完成。
1.9 血浆胆汁酸检测
将小鼠血浆样品于37℃解冻,振荡混匀,取25 μL于1.5 mL离心管中,加入含内标D5 -LCA的乙腈溶液(30 ng/mL) 100μL,涡旋3 min混匀,10 000 r/min离心10 min,吸取80 μL上清至进样瓶中供LC-MS/MS分析[10]。检测血浆CA、GDCA、CDCA、DCA、LCA、TCA、TCDCA、TDCA、GCA、GCDCA等胆汁酸。
空白血浆处理:小鼠血浆加入适量活性炭(100 mg/mL)[11-12]后,振摇1h以吸附内源性胆汁酸,10 000 r/min离心10 min去除活性炭备用。
1.10 RT-PCR检测
按如下操作执行:(1)RNA抽提和反转录:利用TAKARA RNAiso提取总RNA。反转录反应体系:PrimeScriptTM buffer 2μL, PrimeScriptTM RT Enzyme Mix lμL, Random 6 mers 2μL,Total RNA 500 ng, RNase Free dH2O 10μL。反转录条件:将10 μL反应体系放入PCR仪中,37℃1h,然后85℃5 s,得到的产物为cD-NA,-20℃保存。(2)引物设计和合成:SYBR和Taqman两种不同的引物。SYBR引物序列:PXR(NM-010936.3,正向引物序列CCTACATGT-TCAAGGGCGTC反向引物序列TGCACATCT-CAAAAGTGGCC),CYP3A11(NM-007818.3,正向引物序列AGCTCTCTCACTGGAAACCT反向引物序列 AGGTTTGGGCCCAGGAATT),BSEP(NM-021022.3,正向引物序列CTCAGCTGCATGACT-TCGTC反向引物序列AGGATCTCGTACAATGGC-CC),Gapdh(NM-008084.2,正向引物序列AG-GTCGGTGTGAACGGATTTG反向引物序列TG-TAGACCATGTAGTTGAGGTCA);Taqman引物:UGT1A1 (Mm02603337-ml) 和Gapdh(Mm99999915-)购买于lifetech。反应体系:2×SYBRTM buffer 10 μL,上游引物(10 μmol/L)0.6 μL,下游引物(10 μmol/L)0.6 μL,cDNA 2μL,ddH2O 6.8μL。反应程序:50℃2min,5℃10 min,95℃15 s,60℃30 s 40个循环,95℃15s,60℃60 s,95℃15 s。上机分析(3管重复),以2-△△Ct表示目的基因mRNA相对表达量,△△Ct=(Ct目的基因- CtGAPDH)实验组-(Ct目的基因-CtGAPDH)对照组。
1.11 数据处理
所有实验数据均用均数±标准差(±s)表示,采用SPSS 18.0统计软件进行数据分析,使用方差分析( ANOVA)比较5组间是否存在差异,再用Dunnett-t检验比较模型组与正常组、甘草低剂量组、甘草中剂量组及甘草高剂量组之间的差异,检验水准α=0. 05。
2 结果
2.1 各组小鼠的一般情况
正常组小鼠状态良好,毛色正常,尿液澄清微黄,体质量稳定增加。模型组小鼠在第一次造模后出现头顶和背部掉毛;体质量减轻,行动迟缓,尿黄。3组给药组小鼠造模后体质量也减轻,行动迟缓,未出现掉毛现象。小鼠处死后打开腹腔,其中模型组小鼠腹腔内明显变黄,肝脏色泽泛白,有胆栓坏死颗粒,胆囊明显扩大;甘草治疗组胆栓坏死颗粒明显减少,肝脏柔韧无泛白,胆囊大小正常。
2.2 各组小鼠的肝脏病理
正常组、模型组和治疗组肝脏病理见图1。正常组肝小叶结构正常,肝细胞呈索状排列,整齐有序,无坏死及变性,肝窦无扩张,毛细胆管无淤胆,汇管区未见炎性细胞浸润,胆管结构正常;模型组肝细胞混浊肿胀出现大量空泡坏死,可见浆液坏死灶,汇管区有炎性细胞浸润;甘草治疗小鼠肝细胞的坏死程度有所改善,甘草低剂量组可见浆液坏死灶,未见细胞空泡坏死。中、甘草高剂量组未见明显坏死灶,肝细胞形态排列均正常,汇管区有炎性细胞浸润。
2.3 各组小鼠的肝功能
正常组、模型组、甘草水煎液治疗组的TBIL、ALT、AST、ALP水平见表1。与正常组相比,模型组、甘草水煎液治疗组血浆TBIL含量明显升高(P<0.05);与模型组相比,甘草低、中、高剂量组TBIL含量差异皆无统计学意义(P>0.05)。
与正常组相比,模型组、甘草低、中、高剂量组小鼠血浆ALT水平显著升高(P<0.05);与模型组相比,甘草低、中剂量组ALT有下降趋势,甘草高剂量组差异有统计学意义(P<0.05)。与正常组相比,模型组、甘草治疗组小鼠血浆AST水平显著升高(P<0.05);与模型组相比,甘草低、中剂量组AST有下降趋势,甘草高剂量组AST水平下降有统计学意义(P<0.05)。
与正常组相比,模型组、甘草治疗组小鼠血浆ALP水平显著升高(P<0.05);与模型组相比,甘草低、中剂量组ALP有下降趋势,甘草高剂量组可明显降低ALP水平(P<0.05)。
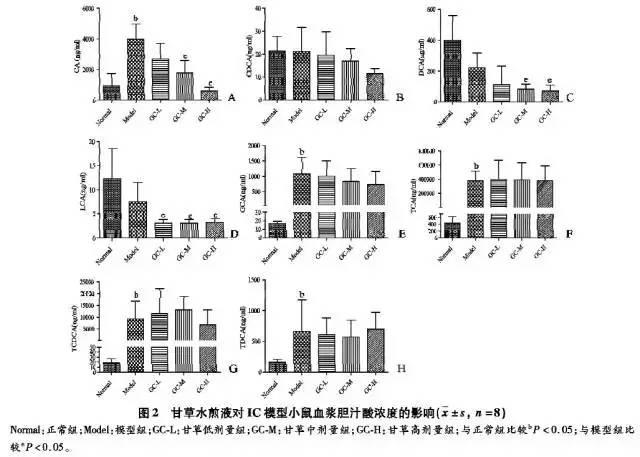
2.4 各组小鼠的血浆胆汁酸浓度
血浆胆汁酸的检测结果见图2。小鼠血浆胆汁酸主要以牛磺酸结合型(T-)及游离型为主,甘氨酸结合型(G-)胆汁酸除GCA外均检测不到。模型组CA、GCA、TCA、TCDCA和TDCA较正常组分别提高4.2倍、63.2倍、870.1倍、502.3倍、4.2倍,而模型组次级胆汁酸DCA、LCA较正常组有所下降,但差异无统计学意义,提示模型组体内胆汁酸明显淤积。与模型组比较,CA在甘草低、中、高剂量分别减少32. 2%、55. 1%和84. 4%;CDCA在甘草低、中剂量组无明显减少,而高剂量减少45. 8%;DCA在甘草低、中、高剂量分别减少49. 1%、52. 5%和67. 1%;LCA在甘草低、中、高剂量分别减少59. 5%、59.5%和56. 7%。与模型组比较,结合胆汁酸(GCA、TCA、TCDCA和TDCA)在甘草低、中、高剂量组减少无统计学差异(P>0.05)。


2.5 甘草水煎液对相关基因mRNA转录的影响
PXR、CYP3A11、UGT1A1和BSEP mRNA转录结果见图3。从图中可以看出:与正常组相比,模型组的PXR、CYP3A11、UGT1A1和BSEP mRNA转录升高。与模型组相比,甘草水煎液对PXR、CYP3A11、UGT1A1和BSEP mRNA的转录升高有显著意义(P<0.05)。

3 结论
ANIT是经典的造模药物,在体内经P450代谢后与谷胱甘肽结合,可引起严重的胆管上皮细胞坏死,伴有胆管周围嗜中性粒细胞浸润,引起肝内胆管增生,从而造成胆管阻塞,引起肝内胆汁淤积[14],现已广泛用于肝内胆汁淤积的研究[15-16]。
本研究发现,模型组小鼠胆囊明显扩张,胃肠道呈灰白色,肝脏病理提示胆管上皮细胞水肿、细胞间隙增大,伴有炎性细胞浸润,胆管管腔变窄,肝细胞明显空泡坏死。与正常组相比,模型组小鼠的肝功能指标ALT、AST、ALP和TBIL水平明显升高(P<0.05),模型组CA、GCA、TCA、TCDCA和TDCA较正常组分别提高4.2倍、63.2倍、870.1倍、502.3倍、4.2倍,提示模型组体内胆汁酸明显淤积,提示肝内胆管淤积模型制造成功。模型组次级胆汁酸DCA、LCA较正常组有所下降。因为DCA、LCA在小肠中由CA和CD-CA经肠道细菌的7α去羟基酶催化生成而来。模型组胆管阻塞,CA和CDCA排泌至小肠中减少,则DCA、LCA产生减少。与模型组相比,甘草低剂量组、中剂量组对肝功能( ALT、AST、ALP)有改善趋势,甘草高剂量组对肝功能改善作用明显:ALT、AST、ALP水平明显降低(P<0.05),肝脏病理提示肝细胞坏死明显改善。甘草水煎液对胆汁淤积小鼠肝损伤具有一定的保护作用,随着剂量增加肝损伤保护作用明显增强。
肝细胞的胆汁酸主要由CYP450酶羟基化后增强亲水性。CYP3A是主要介导胆汁酸羟基化酶,主要受PXR调控。胆汁酸在正常生理状态多与牛磺酸或甘氨酸结合后经胆管排出。胆汁淤积时则更偏向于与葡萄糖醛酸基团结合,通过外排转运蛋白排出肝细胞。尿苷葡萄糖醛酸转移酶类UGTs在胆汁淤积时表达增加,促进胆汁酸代谢;淤积的胆汁酸可通过肝细胞胆管侧的BSEP泵入胆管。UGTs和BSEP还受PXR核受体部分调控[17]。
结果提示甘草水煎液诱导小鼠PXR、CYP3A11、UGT1A1和BSEP的mRNA转录,并有剂量依赖性。CYP3A11、UGT1A1是PXR下游靶基因,PXR对BSEP诱导也有促进作用。CYP3A11和UGT1A1被诱导后可促进胆汁酸的代谢,BSEP被诱导可促进胆汁酸经胆排泄[17]。胆汁酸分游离胆汁酸和结合胆汁酸,游离胆汁酸包括初级胆汁酸(CA、CDCA)和次级胆汁酸( DCA、LCA)。CA、CDCA、DCA、LCA极性弱,肝毒性较强。与模型组比较,CA在甘草低、中、高剂量分别减少32. 2%、55. 1%和84. 4%;CDCA在高剂量减少45. 8%;DCA在甘草低、中、高剂量分别减少49. 1%、52. 5%和67. 1%;LCA在甘草低、中、高剂量分别减少59. 5%、59.5%和56. 7%。游离胆汁酸减少,肝毒性也会减轻。推测CA、CDCA、LCA可能被CYP3A11和UGT1A1代谢和BSEP排泌。与模型组比较,结合胆汁酸(GCA、TCA、TCDCA和TDCA)在治疗组改变不大,这些结合胆汁酸水溶性增大,肝毒性相对较小。
本研究提示甘草水煎液可能通过降低胆汁淤积小鼠的肝内胆汁酸负荷,对IC肝损伤起防治作用。
参考文献【略】
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com