前列腺炎导致生殖器疼(慢性前列腺炎和盆腔疼痛综合征)
慢性前列腺炎/慢性盆腔疼痛综合征 (CP/CPPS) 以会阴部或下腹部区域的慢性疼痛为特征,是男性常见的疾病。先前的研究表明,免疫介质,包括白细胞介素 (IL)-1β、IL-6、干扰素-γ、肿瘤坏死因子-α 和免疫球蛋白,在 CP/CPPS 男性表达的前列腺分泌物和精液中升高。记忆 T、T 辅助细胞 1 (Th1)、Th17 和 Th22 细胞在 CP/CPPS 男性的外周血中增加。此外,在 CP/CPPS 患者中鉴定出前列腺抗原特异性自身反应性 T 细胞。在总体回顾和比较自身免疫性疾病和 CP/CPPS 的炎症反应后,我们推测 CP/CPPS 更可能被定义为自身免疫性疾病。慢性前列腺炎/慢性盆腔疼痛综合征 (CP/CPPS) 是一种发病率很高的泌尿系统疾病,病因不明,患病率为 8.4-25%(Habermacher 等人,2006 年;Zhang 等人,2019 年)。患有 CP/CPPS 的患者通常抱怨会阴、直肠、阴茎、睾丸和下腹部疼痛,导致患者生活质量 (QoL) 下降(Zhang 等人2020a)。尽管美国国立卫生研究院 (NIH) 的共识将 CP/CPPS 定义为没有尿路感染证据的 III 类前列腺炎 (Krieger et al. 1999 ),但感染仍被认为是驱动其发病机制的一个因果因素 (Hou et al. 1999)等人2012 年;墨菲等人2019 年). 已在 CP/CPPS 男性的前列腺分泌物中检测到包括尿路病原体和衣原体在内的病原体(Abdelatif 等人1991 年;Nickel 等人2003a)。墨菲等人。( 2014 ) 揭示了细菌与 CP/CPPS 之间的关联。他们得出结论,细菌感染可能在触发自身免疫激活、形成前列腺炎症反应和驱动 CP/CPPS 方面发挥关键作用。
当免疫耐受性被破坏时,就会发生自身免疫性疾病。随后,免疫系统错误地攻击自身抗原,引起自身免疫过度激活并引起器官和组织损伤(Xiao et al. 2021)。自身免疫性疾病,如自身免疫性甲状腺疾病、1 型糖尿病、系统性红斑狼疮和类风湿性关节炎,已得到系统研究。遗传易感性和环境因素,如感染、紫外线、精神因素、吸烟和食物成分,被确定为激活自身反应性 T 和 B 淋巴细胞的触发因素,通过自身抗体和自身反应性细胞毒性 T 淋巴细胞导致组织损伤(Wang 等人. 2015 年)。
在过去的 2 年里,研究人员提出感染、自身免疫、尿路上皮完整性和功能缺陷以及社会心理状态是 CP/CPPS 的潜在病因(Breser et al. 2017),并且自身免疫病因已被证实在 CP/CPPS 中具有重要作用。CP/CPPS 的发病机制(Lu et al. 2018)。通过自身免疫前列腺抗原(PAgs)建立的实验性自身免疫性前列腺炎(EAP)模型,可以模拟 CP/CPPS 的自身免疫反应,20 多年来被广泛用于研究 CP/CPPS 的免疫改变。Donadio 和 Depiante-Depaoli 1997 年;Keetch 等人1994 年). 已鉴定出几种自身抗原以证明 CP/CPPS 的自身免疫性(Hou 等人2009 年;Ponniah 等人2000 年),并且在 CP/CPPS 患者中发现了 PAgs 特异性淋巴细胞(Motrich 等人2005 年,2020 年)。因此,探索和揭示 CP/CPPS 中的自身免疫反应可以启发 CP/CPPS 的诊断和治疗,并改善患者的生活质量。
本文综述了自身免疫性疾病的病因,并比较了自身免疫性疾病与CP/CPPS的相似性。我们的研究结果可能会为理解 CP/CPPS 和患者的治疗选择提供启发。
病原体在 CP/CPPS 发生中的作用
病原体被认为是 CP/CPPS 的触发因素,尽管没有足够的证据证实感染与 CP/CPPS 之间的关联。细菌种类,包括幽门螺杆菌(Karatas 等人,2010 年)、沙眼衣原体(Park 等人,2015 年)、支原体和解脲脲原体(Papeš 等人,2017 年)、大肠杆菌(E. coli)(Rudick 等人,2011 年) ,Burkholderia cenocepacia(Nickel et al. 2015 ), nanobacteria (Zheng et al. 2014 ), 和其他革兰氏阳性菌 (Murphy et al.2019 ), 被确定为与 CP/CPPS 相关联。抗生素可以减少 NIH 慢性前列腺炎症状指数 (NIH-CPSI) 评分降低所反映的前列腺炎样症状(Franco 等人,2019 年)。此外,细菌 DNA 编码 DNA 序列研究表明,患有 CP/CPPS 的男性前列腺样本中的细菌阳性率高于未患前列腺炎的男性(Krieger 等人,2000 年)。鲁迪克等人。( 2011 ) 分离出致尿路致病性大肠杆菌的CP1菌株从 CP/CPPS 患者中提取,然后将其引入小鼠,目的是诱导 CP/CPPS 模型。然而,即使这种细菌已从泌尿生殖道中清除,非肥胖糖尿病 (NOD) 小鼠仍存在慢性盆腔痛。同时,这种现象无法在 C57BL/6 小鼠中重现。因此,感染是 CP/CPPS 的启动刺激,遗传易感性可能是另一个因素。同样,墨菲等人。( 2019 ) 报道,革兰氏阳性菌在 CP/CPPS 男性前列腺分泌物 (EPS) 菌群中所占比例最大,从 EPS 中分离出的三种菌株,包括粪肠球菌、溶血葡萄球菌和表皮葡萄球菌, 可以在 NOD 小鼠而不是 C57BL/6 小鼠中诱发前列腺炎样症状。在临床试验中,CP/CPPS 患者对抗生素治疗的反应仍然不能令人满意(Magistro 等人2016 年;Nickel 等人2003b),尽管有证据表明细菌可以促进 CP/CPPS 患者的免疫反应。因此,以减少细菌引起的炎症为重点的治疗更能保证患者症状的缓解。
CP/CPPS 的免疫机制
CP/CPPS 的免疫学基础
已检测 EPS、精浆、尿液、血液中细胞因子和免疫细胞的水平,以揭示 CP/CPPS 的免疫学改变。EPS中白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、免疫球蛋白(Ig)A、IgG to PAgs水平升高,尿液和EPS中可见巨噬细胞和T、B淋巴细胞CP/CPPS 男性(Motrich 等人2020 年;Nadler 等人2000 年;Nickel 等人2003a;Shortliffe 和 Wehner 1986 年). Hubert John 等发现,随着 CP/CPPS 的发展,血清 IL-6 和补体 3c(C3c)和 C4 升高,CP/CPPS 患者的射精 IL-6、IgA 和 IgG 水平高于对照组。健康对照组,抗生素治疗后精液 IL-6 水平下降(John et al. 2001 , 2003 ; Stancik et al. 2008). 他们还揭示了一个现象,即T淋巴细胞主要位于腺泡内。相比之下,B 淋巴细胞均匀分布在前列腺间质和腺体中,这表明活化的 T 和 B 淋巴细胞可能会分泌增加的细胞因子和免疫球蛋白水平。他们提出CP/CPPS是由自身免疫成分引起的自身免疫性疾病。此外,观察到 IL-1β、TNF-α 和 IgA、IgM、C3 和纤维蛋白原沉积在患有慢性前列腺炎的男性的前列腺中(Ablin 等人,1971 年;Doble 等人,1990 年;Xie 等人,2010 年)). 为了进一步证实上述发现,我们分析了 CP/CPPS 患者前列腺标本中的这些免疫介质。免疫荧光染色表明,CD4 和干扰素 (IFN)-γ 沉积在良性前列腺增生和 CP/CPPS 患者的前列腺上皮细胞中(补充图 1A-B)。该结果与先前的研究一致,即在患有 CP/CPPS 的个体的精浆中观察到的 IFN-γ 水平高于健康个体(Miller 等人,2002 年)。此外,C3、胶原蛋白-I、胶原蛋白-III、IgA、IgM、IL-1β 和 TNF-α 被发现沉积在该 CP/CPPS 患者的前列腺中(补充图 1C)。因此,自身免疫驱动的前列腺炎症可能是 CP/CPPS 发病机制中的一个重要因素。
CP/CPPS 和 EAP 模型患者自身抗原的鉴定
基于 CP/CPPS 中的自身免疫反应,研究人员确定了 CP/CPPS 发病机制中的自身抗原。例如,侯等人。( 2009 ) 揭示精囊分泌蛋白 2 和 semenogelin 是自身免疫性前列腺炎模型中异常的前列腺特异性自身抗原,并且在血清中还鉴定了患有慢性前列腺炎和自身抗体的男性。此外,其他自身抗原(包括前列腺和雄性附属腺提取物、前列腺类固醇结合蛋白、前列腺精胺结合蛋白(p25)、前列腺酸性磷酸酶(PAP)和T2肽)已在动物模型中得到证实(Liu et al. 2021a ). 在患者中也观察到前列腺特异性抗原 (PSA)、PAP、MAD-PRO-34 和 NY-CO-7 (Dunphy et al. 2004 ); Kouiavskaia 等人。2009 年;莫特里奇等人。2005年;庞尼亚等人。2000 年)。在 CP/CPPS 患者的血液中发现了 PAgs 特异性自身反应性 T 细胞和 PAgs 特异性 IgG(Dunphy 等人2004 年;Kouiavskaia 等人2009 年;Motrich 等人2005 年;Pansadoro 等人1996 年;Ponniah 等人。2000 年)。因此,对 PAg 的免疫耐受性丧失会引发自身免疫反应,从而导致 CP/CPPS。
T 淋巴细胞及其分泌的炎症介质在 CP/CPPS 中的作用
越来越多的证据证明了CD4 T 细胞在 CP/CPPS 的启动和发展中的关键作用(Alexander 等人, 1997 年;Breser 等人,2017 年)。响应于细菌入侵,CD4 T 细胞被激活,然后分化为 Th1、Th2 和 Th17 亚群(Murphy 等人,2014 年),Th1 和 Th17 细胞促进 CP/CPPS 的进展(Breser 等人,2014 年)。2017 年)。
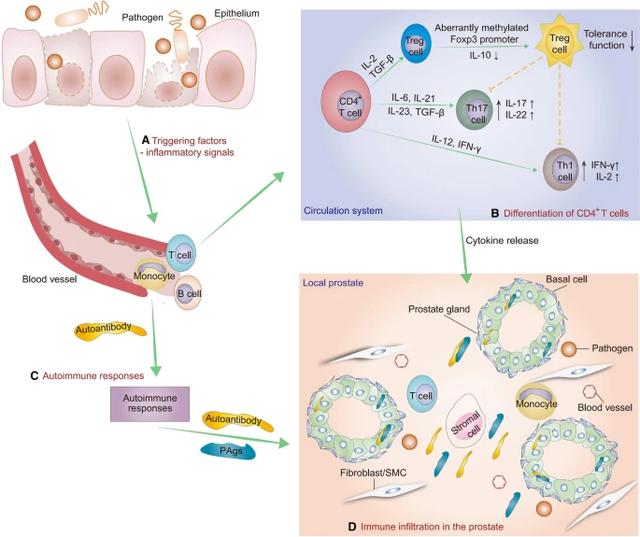
对接种了 CP/CPPS 患者分离细菌的小鼠前列腺的免疫分析表明,CD3 CD8 、CD3 CD4 和分泌 IFN-γ 的 CD4 淋巴细胞浸润在前列腺中,总T 细胞、CD3 CD8 和 CD3 CD4 淋巴细胞在引流前列腺的淋巴结中增加(Murphy 等人,2019 年)。此外,升高的 PSA 被确定为 CP/CPPS 男性中分泌 IFN-γ 的 CD4 T 细胞识别的自身抗原(Motrich 等人,2005 年;Pansadoro 等人,1996 年); 庞尼亚等人。2000 年),患者外周血中自身反应性 CD4 T 细胞的比例增加(Kouiavskaia 等人, 2009 年)。生殖道炎症和精液质量下降与 PAgs 反应性 Th1 和 Th17 细胞相关(Motrich 等人,2020 年)。调节性 T 细胞 (Treg) 参与维持免疫耐受,Foxp3 的转录因子是 Treg 细胞的主要特征(Murphy 等人2014 年;Yang 等人2015 年)。Treg 细胞的功能丧失与 CP/CPPS 中的自身免疫相关(Breser 等人,2016 年)). 我们之前的研究表明,Treg 细胞的抑制功能随着 Foxp3 启动子异常甲基化的增加而受损,导致 EAP 中的自身免疫反应和前列腺组织损伤(Chen 等人,2019 年)。此外,EAP 模型中功能性 Treg 细胞的比例下降,促进了 CP/CPPS 的发展,而自噬可以恢复其抑制功能(Liu et al. 2021b)。我们还通过单细胞多组学分析研究了 CP/CPPS 男性中 T 细胞亚群的比例。结果表明,与健康对照组相比,CP/CPPS 男性外周的记忆 T、Th1、Th17 和 Th22 细胞增加(Zhang et al. 2020b). 基于 Th17 细胞在 CP/CPPS 中的驱动作用,我们发现 Th17 细胞的过度激活会加重前列腺炎样症状,这是由 Ca 2 介导的 CaMK4/Akt/mTOR-IL-17A 信号调节的(Zhan et等人2020 年)。综上所述,血液循环系统和局部前列腺中 Th1、Treg 和 Th17 等淋巴细胞的畸变分化可能促进和加剧 CP/CPPS。
因此,炎症信号可以诱导CD4 T细胞分化为T细胞亚群。免疫耐受因 Treg 细胞数量减少和 Treg 细胞功能受损而受到破坏,使其无法抑制 CP/CPPS 中 Th1 和 Th17 驱动的免疫反应(图 1)。过度激活的自身反应性 T 细胞和 B 细胞促进自身免疫反应,导致前列腺炎症和前列腺损伤。
CP/CPPS 中的自身免疫反应概述。CP/CPPS 发病机制中推定的自身免疫过程。A触发因素,包括病原体的入侵,激活了免疫系统(Hou 等人2012 年;Murphy 等人2019 年);随后,T和B淋巴细胞被抗原处理细胞刺激。B激活的 CD4 T 细胞异常分化为 Th1、Th17 和 Treg 细胞亚群(Murphy 等人,2014 年)。Treg 细胞数量减少和 Treg 细胞功能受损破坏了免疫耐受性,使其无法抑制 CP/CPPS 中 Th1 和 Th17 驱动的免疫反应(Chen 等人,2019 年;Liu 等人,2019 年)。2021b ; 詹等。2020 年;张等。2020b ).C体液免疫在免疫反应过程中起着至关重要的作用。病原体的入侵破坏了机体免疫系统的平衡,异常的 B 细胞产生自身抗体以对抗释放到血液中的自身抗原(Ablin 等人1971 年;Doble 等人1990 年;Motrich 等人2020 年)。D过度激活的自身免疫反应会引发前列腺炎症和慢性疼痛(Motrich 等人,2020 年)。CP/CPPS慢性前列腺炎/慢性盆腔疼痛综合征、IFN-γ干扰素-γ、IL-1β白细胞介素-1β、PAgs前列腺抗原、SMC平滑肌细胞、TNF-α肿瘤坏死因子-α
自身免疫性疾病与 CP/CPPS 在免疫异常方面的相似性
在自身免疫性疾病中,基因-环境相互作用破坏了免疫稳态,幼稚 T 细胞分化为致病效应 T 细胞亚群,包括 Th1、Th2、Th17 和滤泡 Th (Tfh) 细胞(Awasthi 和 Kumar 2019;Kuchroo 等人。2012 年)。Treg 细胞频率和功能的下降无法对抗 Th1、Th2 和 Th17 驱动的炎症反应,导致自身免疫性疾病中 Th1/Th2 和 Th17/Treg 失衡(Awasthi 和 Kumar 2019;Hill 等人2007)。如上所述,在 CP/CPPS 病例中,Tregs 的频率和功能下降以及 Th1、Th2 和 Th17 的频率和功能增加得到很好的表征(Chen 等人,2019 年;Murphy 等人,2019 年)。2014 年;快速等。2013 年;詹等。2020 年)。分泌 IFN-γ 的 Th1 细胞和分泌 IL-17 的 Th17 细胞与自身免疫性疾病的发展有关(Bettelli 等人2004 年;Haase 和 Linker 2021 年;Vyas 等人2019 年;Yasuda 等人2019 年)。在体液反应中,Tfh 细胞的过度激活会诱导自身反应性 B 细胞产生自身抗体,从而将特定的免疫细胞募集到靶器官并导致组织损伤和临床症状(Kuchroo 等人2012 年;Ma 等人2017 年)). 此外,“Th1 样”细胞(也称为 Th17/Th1 细胞)从 Th17 细胞分化而来,可以分泌 IL-17 和 IFN-γ(Basdeo 等人,2017 年)。“Th1 样”细胞更具致病性,可在自身免疫性疾病中诱导对糖皮质激素的耐药性(Ramesh 等人,2014 年)。因此,免疫网络在自身免疫性疾病的发病机制中起着关键作用,并可能作为中心治疗靶点。
综合查阅相关文献可知,CP/CPPS 中的免疫反应与自身免疫性疾病有许多相似之处,现总结如下。(1) CP/CPPS 和自身免疫性疾病是由感染和精神状态等多因素引起的。(2)自身免疫反应在CP/CPPS和自身免疫性疾病的发病机制中起关键作用。此外,Treg 细胞的丧失耐受功能和自身反应性 T 细胞和 B 细胞的异常激活会引发炎症反应,从而导致组织损伤。(3) Th1 和 Th17 驱动的自身免疫在这两种情况的自身免疫过程中起主导作用。(4) 以减轻炎症浸润为目标的治疗策略在CP/CPPS和自身免疫性疾病的治疗中具有广阔前景。
自身免疫性疾病治疗CP/CPPS的启示
CP/CPPS 是一种以多发性病因为特征的复杂疾病。病原体感染和免疫耐受的丧失可能导致前列腺自身免疫性炎症损伤,导致慢性盆腔疼痛。因此,自身免疫过程可能为 CP/CPPS 患者提供潜在的治疗靶点。目前的治疗方法(如α-受体阻滞剂、5-α还原酶抑制剂、抗生素、抗炎药、植物疗法、A型肉毒杆菌毒素、别嘌醇和中药)已被广泛研究,而CP/CPPS患者对这些治疗的反应方法仍然不能令人满意(Franco 等人,2019 年)。
针对异常自身免疫
针对自身免疫的疗法已在自身免疫性疾病的治疗中得到广泛研究。最初,Treg 细胞对自身免疫性疾病具有潜在的治疗作用。Treg 细胞有两个亚群:天然 Treg (nTreg) 和诱导 (iTreg) 细胞。其中,nTreg 细胞来源于胸腺,而 iTreg 细胞来源于外周的常规 CD4 T 细胞(Ruszkowski et al. 2019)。由于自身免疫性疾病部分归因于 Treg 细胞耐受功能的丧失,因此将 Treg 细胞过继转移到动物模型中或增强动物模型的 Treg 功能以恢复免疫耐受在自身免疫性疾病的治疗中似乎很有希望(Esensten 等人,2018 年) ; Geem 等人,2015 年; Haribhai 等人。2016 年;库马尔等。2019 年)。此外,缓解疾病的抗风湿药(包括甲氨蝶呤、柳氮磺胺吡啶、来氟米特、金盐和羟氯喹)、皮质类固醇、细胞毒性免疫抑制剂(环磷酰胺、硫唑嘌呤、霉酚酸酯和神经钙蛋白抑制剂)、非甾体抗炎药、生物制剂和小分子药物(利妥昔单抗、贝利木单抗)广泛应用于自身免疫性疾病的治疗,以调节过度激活的自身免疫反应并缓解自身免疫性疾病(Fava and Petri 2019;Sparks 2019). 特别是,近年来以 IL-1、TNF-α、IL-6、IL-23、IL-17、IL-4/13、IL-5 和 CD20 为靶点的生物治疗药物取得了长足的进步,免疫和炎症性疾病患者可以从这些药物中受益(Ghilardi 等人,2020 年)。
鉴于CP/CPPS的自身免疫性,我们或许可以从自身免疫性疾病的治疗中获得一些启示。CP/CPPS 的几种治疗剂可以抑制免疫反应。例如,槲皮素和针灸已被证明在 CP/CPPS 男性或动物模型中发挥抗炎活性并降低细胞因子如 IL-1β、IL-8、IL-10 和 TNF-α 的水平(Meng 等等人2018 年;Wazir 等人2019 年)。针对神经生长因子 (NGF) 和 TNF-α 的单克隆抗体 (mAb) 被用于控制神经源性炎症和缓解疼痛(Wazir 等人,2019 年)。一项随机临床试验表明,一种 NGF 的单克隆抗体 tanezumab 可以改善 CP/CPPS 患者的疼痛症状(Nickel 等人,2016 年)。2012 年;叶等人。2017 年)。喹诺酮类药物是一种常用于治疗 CP/CPPS 的抗生素,被发现可促进 IL-2 和集落刺激因子,同时抑制 IL-1 和 TNF-α 合成(Dalhoff 和 Shalit 2003)。此外,喹诺酮类药物可以通过靶向下游效应物来调节免疫反应,包括环腺苷 3',5'-单磷酸、磷酸二酯酶、激活蛋白 1、核因子 (NF)-κB、NF/IL-6 和核因子激活的 T 细胞(Dalhoff 和 Shalit 2003)。因此,除了去除细菌外,一些抗生素还可以调节炎症反应。这可以部分解释抗生素对没有感染证据的 CP/CPPS 男性治疗的影响。
皮质类固醇的应用
在脊椎动物中,皮质类固醇从肾上腺皮质分泌,具有抗炎和免疫抑制作用(Stern 等人,2017 年)。在 CP/CPPS 中,皮质类固醇治疗可能通过抑制自身免疫过程显着影响某些患者(Tomaskovic 等人,2009 年)。Bates 和 Talbot ( 2000 ) 对四名 CP/CPPS 男性应用短期口服皮质类固醇,75% 的患者受益于类固醇治疗。此外,对于伴有溃疡性结肠炎的 CP/CPPS 直肠泼尼松龙给药可以缓解疼痛(Talbot 和 Bates 2001)。因此,有必要对患有 CP/CPPS 的男性进行皮质类固醇的随机临床试验 (RCT)(Magistro 等人,2016 年); Strauss 和 Dimitrakov 2010)。贝茨等人。( 2007 ) 进行了涉及 18 名患者的随机对照试验,以研究口服皮质类固醇对 CP/CPPS 的影响,揭示皮质类固醇治疗后前列腺炎样症状没有改善,而抑郁症状有所改善。在另一项涉及 160 名患者的随机对照试验中,强的松和左氧氟沙星同时给予慢性非细菌性前列腺炎患者。结果表明,治疗后 EPS 中的白细胞计数减少后,QoL、疼痛症状和排尿功能障碍得到改善(Yang 等人,2009 年)。这两个随机对照试验之间的差异可能是由于参加随机对照试验的参与者数量有限。
指导临床治疗的遗传分析
此外,遗传风险因素可能在影响 CP/CPPS 的治疗效果方面发挥重要作用。肖克斯等人。( 2002 ) 确定具有低 TNF-α 和高 IL-10 表型的 CP/CPPS 男性在抗炎植物疗法方面往往会导致治疗失败。研究人员提出,可以应用基因型和表型对 CP/CPPS 进行分层,从而使治疗效果最大化(Dimitrakov 和 Guthrie 2009)。综上所述,确定干预 CP/CPPS 自身免疫反应的新治疗靶点可能有效缓解疾病。
结论
总之,Treg细胞功能受损导致T细胞异常分化,Th1/Th17驱动的自身免疫诱发并加重前列腺炎症和损伤,导致慢性盆腔疼痛。鉴于自身免疫在 CP/CPPS 的启动和进展中的关键作用,针对自身免疫反应的治疗策略很有希望。
Chen L, Zhang M, Liang C. Chronic Prostatitis and Pelvic Pain Syndrome: Another Autoimmune Disease? Arch Immunol Ther Exp (Warsz). 2021 Sep 14;69(1):24. doi: 10.1007/s00005-021-00628-3. PMID: 34523016.
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com