化学学科知识与教学能力初中(笔试干货中学学科知识与能力教学设计示例之化学)
小编的小阔爱萌,教学设计作为中学《学科知识与能力》中的重要大题,可以说是至关重要了

今天小编就给大家送上中学《学科知识与能力》教学设计示例之化学(内含初中和高中两个学段)给大家参考,希望小伙伴们能够从中学到知识或者技巧,祝大家早日拿证。
初中化学
《氧气》——氧气的化学性质
➡课文来源:人教版《化学》九年级上册第二单元课题2
➡教学建议:
1. 重点是氧气的化学性质及化合反应的概念。以氧气的化学性质为核心,通过氧气能发生的一些具体的化学反应,归纳出化合反应、氧化反应的概念。
2. 教师可以通过演示实验,组织学生观察、描述记录实验现象,采用边实验、边观察的方法学习氧气的化学性质;通过对比几个化学变化,引导学生根据实验结果,分析概括归纳出化合反应与氧化反应的概念。
3. 对氧气的化学性质的认识必须通过观察实验来获得:通过带火星的木条复燃的实验推断氧气具有助燃性,便于学生理解硫、铁丝在空气、氧气中反应现象不同的原因,通过分析原因还可以让学生进一步理解混合物、纯净物的概念。
➡有关资料:
1. 铁丝与氧气在点燃条件下发生反应,会生成高温的四氧化三铁,为了防止炸裂瓶底,需要在瓶底放一层水或者细沙;
2. 化合反应:两种或两种以上的物质生成另一种物质的反应,特点“多变一”;氧化反应:在初中阶段,物质与氧气的反应。
【教案设计】
氧气——氧气的化学性质
一、教学目标
【知识与技能】
氧气的化学性质,了解什么是化合反应,氧化反应
【过程与方法】
通过对氧气性质的实验探究,提高观察与总结能力,学习探究气体性质的方法。
【情感态度与价值观】
培养学习化学的兴趣
二、教学重难点
【重点】
氧气的化学性质和化合反应的概念
【难点】
文字表达式的书写
三、教学过程
环节一:导入新课
【提出问题】假如你去攀登喜马拉雅山,你会准备哪些必用品?
【学生回答】①厚衣服。因为高海拔地区冷,要做好保暖
②登山绳、防滑鞋。因为可能遇到峭壁等,还要防止在雪地上摔跤
③氧气瓶。因为高海拔地区空气稀薄
【教师引导】从同学们的回答中我们已经知道氧气是一种供给呼吸的气体,那么氧气有没有其他的化学性质呢?这一章我们就来学习“氧气的化学性质”。
环节二:新课讲授
1. 木炭与氧气的反应
【教师实验】将木炭在空气中点燃,再伸入盛有氧气的氧气瓶中,对比实验现象有何不同?解释原因?
【学生回答】木炭在氧气中燃烧更剧烈,说明氧气是一种能支持燃烧的气体
【教师实验】向氧气瓶中加入澄清的石灰水,观察到了什么现象?
【学生回答】澄清的石灰水变混浊了
【教师讲授】二氧化碳能使澄清石灰水变浑浊,说明木炭和氧气反应生成二氧化碳。(板书:碳 氧气点燃二氧化碳)
2. 碳与氧气的反应
【教师实验】在燃烧匙中,放入少量碳点燃至燃烧,再将其伸入盛有少量氧气的氧气瓶,对比实验现象有何不同?
【学生回答】碳在空气中燃烧发出微微弱的淡蓝色火焰,在纯氧中发出明亮的蓝紫色火焰,并且生成一种有刺激性气味的气体。
【教师实验】碳与氧气发生化学反应,生成了一种带有刺激性气味的二氧化硫气体,并放出热量。
【学生回答】能否仿照木炭与氧气反应的文字表达式,写出硫与氧气发生反应的文字表达式?
3. 铁丝与氧气的反应
【教师引导】非金属木炭,硫磺都可以与氧气发生反应,那么金属是否也能与氧气发生化学反应?
【播放视频】铁丝在空气中与在氧气中的对比燃烧实验,观察实验现象。
【学生回答】铁丝在空气中加热发红但是没有燃烧,铁丝在氧气中剧烈燃烧,火星四射,发出耀眼的白光,并且生成黑色固体。
【教师引导】生成的黑色固体是四氧化三铁,并且反应会放出大量的热,对比前两个实验,写出文字表达式?
【学生回答】铁 氧气点燃四氧化三铁
【提出问题】为什么铁丝与氧气反应实验时,铁丝要是螺旋状的?为什么要在瓶底放一些水?
【学生回答】螺旋状可以增大受热面积,使铁丝持续燃烧,在瓶底加少量水是为了防止生成的固体物质溅落在瓶底,导致集气瓶炸裂。
4. 氧气的助燃性
【提出问题】观察以上三个实验,木炭,硫,铁丝在空气和氧气中的反应现象,推断氧气具有怎样的性质?
【学生回答】木炭、硫、铁丝在氧气中反应更加剧烈,说明氧气能够支持燃烧
5. 化合反应与氧化反应
【提出问题】观察对比这些实验的文字表达式,从反应物与生成物的种类来看,有什么共同点?
【学生回答】都是多种物质生成一种物质的反应,并且都有氧气参与反应。
【教师讲授】我们把有两种或两种以上物质生成另一种物质的反应,叫做化合反应,在初中阶段,我们把物质与氧气发生的反应叫做氧化反应。
环节三:巩固提高
已知盐酸和氢氧化钠反应生成氯化钠和水,这一反应是否属于化合反应?
解析:不属于。因为化合反应是由两种或两种以上物质生成另一种物质的反应,盐酸和氢氧化钠反应生成氯化钠和水的反应是两种物质生成两种物质的反应。
环节四:小结作业
请学生回答本堂课的收获:氧气的化学性质。
布置作业:根据本节课所学习的氧气的化学性质来说一说,氧气在日常生活生产中的应用有哪些?
四、板书设计
氧气的化学性质
1. 木炭与氧气的反应:碳 氧气点燃二氧化碳
2. 硫与氧气的反应:硫 氧气点燃二氧化硫
3. 铁丝与氧气的反应:铁 氧气点燃四氧化三铁
4. 氧气的助燃性
五、教学反思(略)
高中化学
《氧化还原反应》
➡课文来源:普通高中课程标准实验教科书人教版《化学》必修1第二章第三节
➡教学建议:
①学生在初中的时候就已经学习了氧化反应、还原反应,因此在导入本节新课的时候可以采用温故
知新的导入方式。
②通过让学生分析有得失氧的氧化还原反应,观察各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价升降的关系。再通过铁与硫酸铜的反应,将氧化还原反应扩大到虽然没有得氧、失氧,但反应前后元素化合价有升降的氧化还原反应,引出氧化还原反应的特征。
③要认识氧化还原反应的实质,要从微观的角度来认识。通过钠与氯气的反应、氢气与氯气的反应,从原子结构的角度讨论氧化还原反应与电子转移的关系,并且从电子转移的角度给氧化还原反应下一个更为本质的定义。
➡有关资料:
①氧化还原反应的特征:反应前后有元素的化合价发生改变。
②氧化还原反应的本质:电子的得失或电子对的偏移(即电子的转移)。
③从电子转移的角度来看:
氧化反应:被氧化的元素原子失去电子(电子对偏离),化合价升高;还原反应:被还原的元素原子获得电子(电子对偏向),化合价降低。
【教案设计】
氧化还原反应
一、教学目标
【知识与技能】
1. 能够从化合价升降和电子转移的角度认识氧化还原反应。
2. 理解氧化还原的本质是电子的转移(得失或偏移);
3. 会用双线桥法分析氧化还原反应的电子转移情况。
【过程与方法】
通过对氧化还原反应的特征和本质的分析,学习由表及里以及由特殊到一般的逻辑推理方法。
【情感态度与价值观】
通过“氧化”和“还原”这一对典型矛盾的深入研究,深刻体会自然现象中的对立与统一关系,树立辩证唯物主义思想。
二、教学重难点
【重点】
氧化还原反应的特征。
【难点】
氧化还原反应的本质。
三、教学过程
环节一:导入新课
【教师提问】回忆一下初中学过的知识,什么是氧化反应,什么是还原反应,能不能举出几个具体的实例呢?
【学生回答】氧化反应:碳与氧气、铁与氧气……
还原反应:氢气还原氧化铜、碳还原氧化铜、一氧化碳还原氧化铜……
【教师引导】通过大屏幕出示碳还原氧化铜的化学反应方程式:C 2CuO高温CO2↑ 2Cu。在这个反应中,氧化铜失去氧变成单质铜,发生了还原反应。进一步分析,我们发现,在这个反应中碳得到了氧变成了二氧化碳,发生了氧化反应,氧化反应与还原反应是同时发生的,我们就把这样的反应称为氧化还原反应。
环节二:新课讲授
1. 氧化还原反应的特征
【提出问题】能不能举出其它的氧化还原反应?
【学生回答】碳与氢气的反应、氢气还原氧化铜……
【提出问题】观察一下所列举的几个化学方程式,除了得失氧之外,从化学价的角度思考什么是氧化还原反应?
【学生回答】得氧元素发生氧化反应,元素化合价升高;失氧元素发生还原反应,元素化合价降低。
【教师引导】由此可知,氧化还原反应的特征就是有元素化合价升降的变化。
【提出问题】铁与硫酸铜的反应是否属于氧化还原反应?是不是只有得失氧的化学反应才是氧化还原反应?
【学生回答】是,铁元素、铜元素的化合价都出现了变化。可知并不是只有得失氧的反应才是氧化还原反应。
2. 氧化还原反应的本质
【提出问题】为什么在氧化还原反应中会出现化合价的升降变化?元素化合价的升降与什么有关?
【学生回答】元素化合价的变化与得失电子(电子转移)有关。
【教师引导】那么就从原子结构的角度揭秘在氧化还原反应中,元素的化合价为什么会发生变化。
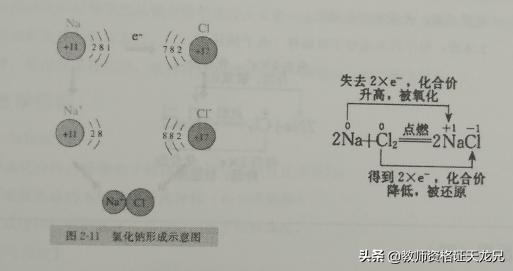
【提出问题】金属钠在氯气中燃烧生成NaCl,从原子结构示意图的角度思考NaCl是怎样形成的?
【学生思考,教师讲解】,从原子结构来看,钠原子的最外电子层上有1个电子,氯原
子的最外电子层上有7个电子。当钠与氯气反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na );氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl−)。这样双方最外电子层都达到了8个电子的稳定结构.钠元素的化合价由0价升高到 1价,被氧化;氯元素的化合价由0价降低到-1价,被还原。在这个反应中,发生了电子的得失,金属钠发生了氧化反应,氯气发生了还原反应。(教师讲解并板书,利用双线桥法)。
【提出问题】氢气在氯气中燃烧生成HCl,从原子结构示意图的角度思考HCl是怎样形成的?
【学生思考,教师讲解】从原子结构来看,氢原子最外层有1个电子,可获得1个电子
而形成2个电子的稳定结构。氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构。
这两种元素的原子获取电子难易程度相差不大。在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使对方最外电子层都达到稳定结构。在氯化氢分子里,由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向氯原子而偏离于氢原子。因此,氧元素的化合价从0价升高到 1价,被氧化;氯元素的化合价从0价降低到-l价。在这个反应中,发生了共用电子对的偏移,氢气发生了氧化反应,氯气发生了还原反应。(教师讲解并板书)
【提出问题】根据以上的分析,能不能从电子转移的角度重新定义氧化还原反应?
【学生回答】有电子转移(得失或偏移)的反应,是氧化还原反应。(教师总结并板书)
【提出问题】能不能从电子转移的角度分析铁与硫酸铜的反应?
【学生回答】铁元素失去2个电子,化合价升高,发生氧化反应;铁元素得到2个电子,化合价降低,发生还原反应。(教师板书:利用双线桥法)
环节三:巩固提升
【提出问题】有人说置换反应、有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应,你认为这个说法正确吗?请说明理由。
提示:正确。因为在这几类反应中,反应前后前后都有元素化合价发生变化。环节四:小结作业
请学生回答本堂课的收获:氧化还原反应的特征、本质,学到了什么?布置作业:课下思考,四大反应类型与氧化还原反应有什么关系。
四、板书设计

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






