化学除杂质的方法归纳口诀(常用除杂质的物理方法)

物质的除杂又叫物质的提纯,是把混合物中少量的杂质除去,得到纯净的物质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。除杂题是中学化学的常见题,它灵活多变,可以综合考察学生的解题能力。现列举几种物理除杂方法:
一、除杂必须遵守的原则
1. 不增:不能增加新的杂质。
2. 不减:被提纯的物质不能减少。
3. 易分:操作简便,易于分离。
二、常用物理方法
根据被提纯物质与杂质的物理性质的联系和差异,其除杂的方法主要有:
1.过滤
⑴ 原理:根据固体的溶解度不同,把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。过滤是除去溶液里混有不溶于溶剂的杂质的方法。
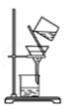
⑵ 适用范围:不溶固体和液体间的分离。如用过滤法除去粗食盐中少量的泥沙。
⑶ 仪器:漏斗、铁架台、烧杯、玻璃棒、滤纸
⑷ 操作要领:要做到一贴、二低、三靠、四洗。
① 一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁,纸和壁间无气泡。
② 二低:滤纸边缘略低于漏斗口,漏斗中液体的液面应略低于滤纸的边缘。
③ 三靠:倾倒过滤液的烧杯口紧靠玻璃棒;玻璃棒的末端轻轻靠在三层滤纸一边;漏斗颈的末端管口应与接受器的内壁紧靠。
④ 四洗:如果过滤的目的是为了得到沉淀,要用蒸馏水洗涤沉淀物,通过过滤器洗涤沉淀的方法:向过滤器中加蒸馏水,使水面没过沉淀物,待溶液全部滤出后,重复操作2~3次。
⑸ 注意:对于有些溶液,温度下降,会有晶体析出,应该趁热过滤。
⑹ 例举:除去食盐中的泥沙。将含有泥沙的食盐溶于水,利用食盐溶于水而泥沙不溶,通过过滤把泥沙从食盐中除去,再把滤液蒸干即得纯净的食盐。
如氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。如果要获得杂质碳酸钙,可洗涤烘干。
思考:如何判断沉淀是否洗净?
提示:取洗涤液,检测其中不含沉淀表面的可溶物质的离子。
2.蒸发

⑴ 原理:蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。
⑵ 范围:适合于把可溶性固体从溶剂中分离出来。
⑶ 仪器:铁架台(带铁圈)、蒸发皿、酒精灯、玻璃棒 。
⑷ 注意: a 用玻璃棒搅拌直至少量溶剂;
b 溶剂易挥发或易燃烧,采用水浴加热。
⑸ 例举:从氯化钠溶液中提取氯化钠,蒸发溶液,使氯化钠析出。
3. 结晶
⑴ 原理:结晶是溶质从溶液中析出晶体的过程,适用于分离可溶性混合物或除去可溶性杂质。几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度和溶解度随温度的变化趋势不同,可用结晶的方法分离。
⑵ 条件:固体的溶解度小或者固体的溶解度随温度升高变化较大。
⑶ 范围:固体的溶解度小一般用蒸发结晶法;固体的溶解度随温度升高变化较大,一般用冷却结晶法或者重结晶法。
⑷ 仪器:过滤仪器、蒸发仪器。
⑸ 操作步骤:把混合物制成高温下的饱和溶液,降温结晶。
基本环节:溶解—蒸发浓缩—趁热过滤—冷却结晶—洗涤干燥
注意点:加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热。
⑹ 类型:有蒸发溶剂结晶(蒸发结晶)和冷却热饱和溶液结晶(冷却或降温结晶)。适用于溶解度随温度变化不大的溶质。
⑺ 例举:从食盐水中提取氯化钠晶体,蒸发浓缩,冷却结晶,就可以得到氯化钠。
4. 重结晶
⑴ 原理:当溶液蒸发浓缩到一定浓度后,冷却就会有溶质的晶体析出,如果结晶所得的物质纯度不符合要求,需要重新加入一定溶剂进行溶解、蒸发和再次结晶,这个过程称为重结晶。
⑵ 适用条件
① 杂质在所选溶剂中溶解度很大或很小,易于除去。
② 被提纯的物质在所选溶剂中的溶解度受温度的影响较大;该物质在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出。
⑶ 实验装置与操作步骤

加热溶解―→趁热过滤―→冷却结晶
如:将KNO3和NaCl分离,硝酸钾的溶解度随温度的升高增大,而氯化钠几乎不变,利用这个性质可以将二者分离,具体操作如下:
利用二者的溶解度不同,将混合物配成溶液,加热至沸腾,浓缩至一定程度时,氯化钠先达到饱和析出,此温度下硝酸钾的溶解度极大,仍然留在母液中。待到大量氯化钠析出后,停止加热,趁热过滤(防止温度下降硝酸钾析出)。氯化钠以晶体形式存在,而硝酸钾仍以溶液态留在母液中,再对滤液进行冷却结晶得到硝酸钾晶体以此达到分离的目的。为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
5.蒸馏、分馏
蒸馏是提纯或分离沸点不同的液体混合物的方法。
用蒸馏原理进行多次多种混合液体的分离,叫分馏。
混合液中各成分经加热,将沸点低的物质先分离出来。

⑴ 原理:利用液体的沸点不同,经过加热冷凝使液体分离的操作。
⑵ 条件:液体的沸点相差比较大。
⑶ 范围:适用于沸点不同且互溶的液体混合物的分离。
⑷ 仪器:酒精灯、铁架台(带铁圈、铁夹)、石棉网、蒸馏烧瓶、冷凝管、接应管、锥形瓶、温度计。
⑸ 操作要领:
① 在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。
② 温度计水银球的上缘应与蒸馏烧瓶支管口下缘位于同一水平线上,以测定蒸气的温度。
③ 蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于 l/3。
④ 冷凝管中冷却水流向,逆流冷凝。从下口进,上口出,以达到较好的冷凝效果。
⑤ 加热温度不能超过混合物中沸点最高物质的沸点。
⑹ 例举:酒精中混有水,加氧化钙,蒸馏可除去水;除去乙醚中少量的酒精。
用分馏的方法进行石油的分馏。
6. 萃取

⑴ 原理:利用溶质在互不相溶的溶剂中溶解度的不同,选择萃取剂将溶质从一种溶剂中转移到另一种溶剂中的方法。
⑵ 选用萃取剂的原则:
① 萃取剂与原溶剂互不相溶;如萃取溴水中的溴或碘水中的碘就不能用酒精。
② 溶质在萃取剂中溶解度要大于原溶剂中的溶解度。
③ 萃取剂与原溶剂和被提取物不反应。
④ 萃取剂与被萃取的物质要易于分离。
⑶ 范围:适合于溶质在互不相溶的液体中的分离。
⑷ 仪器:分液漏斗、铁架台(带铁圈)、烧杯
⑸ 注意:① 事先检查分液漏斗是否漏液;
② 分别从分液漏斗上、下口分离两层液体。加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。
⑹ 例举:从碘水中提取碘,加四氯化碳,振荡后用分液漏斗分离。
7. 分液
⑴ 原理:用分液漏斗将两种密度不同且又互不相溶的液体混合物分离的方法。
⑵ 条件:液体互不相溶
⑶ 范围:适合于把两种互不相溶、密度也不相同的液体分离。
⑷ 仪器:分液漏斗、铁架台(带铁圈)、烧杯
⑸ 操作要领:装液→混合振荡→静置分层→分液,待液体分层后,将分液漏斗上部的玻璃塞打开,或使玻璃塞上的凹槽对准瓶颈部的小孔(使漏斗内外空气相通,便于放出下层液体),再将分液漏斗下面的活塞拧开,下层液体从分液漏斗下端慢慢流出,当下层液体刚好流完便立即关闭活塞,不要让上层液体流出。上层液体要从分液漏斗上口倒出。
⑹ 注意:①分液操作时注意“先下后上、下流上倒”的顺序。下层液体从下口放出,上层液体从上口倒出。
② 为确保液体顺利流出,一定要打开分液漏斗上部的玻璃塞或使瓶塞的凹槽与瓶颈处的小孔对齐,与大气相通。
⑺ 例举:乙酸乙酯与饱和Na2CO3溶液,苯和水分离。
8.渗析
⑴ 原理:利用半透膜(如膀胱膜、羊皮纸、玻璃纸等),使胶体跟混在其中的分子、离子分离的方法。常用渗析的方法来提纯、精制胶体溶液。
⑵ 条件:一种是胶体,一种是溶液
⑶ 范围:渗析适用于胶体与溶液的分离。
⑷ 仪器:烧杯、半透膜袋
⑸ 方法:将混有离子或小分子杂质的胶体装入半透膜的袋里,再把半透膜袋浸泡在水里,若使渗析效率提高,可多次换水或将袋放在水流中,从而使离子和分子从胶体溶液里分离出来。
⑹ 注意:最好在流动的水中进行
⑺ 例举:鸡蛋白中混有少量氯化钠,把混合溶液装在半透膜袋中,置于流动的水中。
9. 洗气



⑴ 原理:利用气体的溶解性或化学性质不同,将混合气体分离开来的方法。
⑵ 条件:一种气体不溶或不反应,一种气体可溶或可反应。
⑶ 范围:适合于混合气体的分离。
⑷ 仪器:洗气瓶、导管
⑸ 注意:不要引进新的气体杂质,最后能够产生被提纯的气体。
⑹ 例举:CO2气体中在混有HCl气体,将混合气体通过水洗去HCl。
10. 盐析
⑴ 原理:利用轻金属盐能够降低胶体溶解度的性质,分离提纯胶体的方法
⑵ 条件:一种是胶体,一种是溶剂
⑶ 范围:适合胶体和溶剂的分离
⑷ 仪器:烧杯、过滤装置
⑸ 注意:方法是盐析,操作是过滤
⑹ 例举:硬脂酸钠中混有甘油,加少量食盐,使硬脂酸钠析出,然后过滤分离。
11. 色谱
⑴ 原理:利用吸附剂对不同有机物的吸附作用不同分离提纯有机物的操作。
⑵ 条件:同一吸附剂吸附有机物能力不同。
⑶ 范围:适合分离吸附能力不同的有机物。
⑷ 仪器:吸附柱
⑸ 注意:选择碳酸钙、硅胶、氧化铝、活性炭等吸附剂
⑹ 例举:叶绿素和叶黄素的分离,以碳酸钙粉末为吸附剂,装入吸附柱中,加入混合物分离。
12. 升华

⑴ 原理:固态物质加热时不经过液态而直接变为气态,蒸气受到冷却后又直接冷凝为固体,这个过程叫做升华。
⑵ 条件:利用某些物质具有升华的特性,将这种物质和其它受热不升华的物质分离开来。
⑶ 范围:升华法只能用于在不太高的温度下有足够大的蒸气压的固态物质的分离与提纯。
⑷ 仪器: 酒精灯、铁架台(带铁圈)、烧杯、烧瓶
⑸ 注意:① 要注意温度的控制得当,最好用水浴加热进行实验。
② 用加冷水的圆底烧瓶底部收集,要注意升华的烧杯口要适中。
⑹ 例举:加热使碘升华,来分离I2和SiO2的混合物。樟脑或萘与氯化钠的混合物。
但NH4Cl固体中的I2不能用升华的方法分离。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






