化学高中部分易错知识点总结(精选文章高中化学易错专题详解)

感谢您关注高中化学公众号,如您尚未关注,点击标题下方"高中化学”关注我们,即可获取教育经验、方法、学习资料等,每天与您相约!



【易错题1】一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)



A.保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
『错解分析』错选A或C,错选A因为在甲中再加入1mol A和2molB与开始加入的和在一起与乙中物质的量相当,但体积只有乙的一半,所以认为A正确;错选C因为甲的量相当于乙中量的一半,当体积相等时就有B正确。错选A,B都是因为忽略在改变条件时,该平衡发生了移动,因此必须在新的条件下考虑各组分量的关系。
『正确解答』做好此题关键是分析清楚,条件改变,平衡如何移动。A中可以建立假设的思维模型,设甲的体积与乙的相等,按两次投料后建立平衡,此时与乙等效,再将甲的体积缩小为原来的一半,平衡会向逆向移动,C的量就会小于乙中C的浓度的2倍,B中升高温度,平衡逆向移动,B的体积增加,而气体总体积却减少,甲、乙中B的体积分数均增大;C中相当于压缩乙,增大压强,平衡向逆向移动,乙中C的体积分数小于甲中C的体积分数的2倍;D中由于K不动,增加氦气不影响平衡移动,而乙由于增加了气体的量,活塞右移,体积增大,压强减小,所以平衡发生向正向移动。故D正确。答案为BD。
『规律小结』对于化学平衡移动问题的分析可建立以下思维模式:

由外界条件的改变结合反应的特点(正反应为吸热还是放热反应、正反应是气体体积增大还是缩小的反应)可以判断平衡移动的方向,平衡移动必然导致各种量变;反过来,由题目告知的量变信息,可以反过来判断平衡移动的方向,再由平衡移动的方向结合反应特点(或条件的改变)可以判断条件的改变(或反应特点)。那么,在具体解题时,我们所要做的是由题中信息分析“条件的改变”、“反应的特点”、“各种量变”等内容,然后根据它们的联系作答。
专题七 元素周期表、元素周期律【易错题1】下列各项内容中,排列顺序正确的是( )
① 固体的热稳定性:Na2CO3>CaCO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4 的浓度:
(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K >S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
『错解分析』错解A或D,③中K在第四周期,而S在第三周期,故③正确,⑤中原子量Se>S>O,形成结构相似的物质,其分子量越大沸点越高。故⑤正确。
『正确解答』①中碳酸氢纳加热易分解,碳酸钙高温分解,而碳酸钠性质稳定故正确;②碳酸铵在溶液中碳酸根离子会促进铵根离子水解,故正确;③因原子核外电子排布相同,核电荷数越大半径越小故微粒半径:K <s< font="">2-④酸性越弱给出质子能力越弱,水和乙醇给出质子能力相比可从它们与纳反应的剧烈程度去理解正确顺序应为:CH3COOH>H2O>C2H5OH⑤正确顺序为H2O>H2Se>H2S。答案为C。
『规律小结』原子半径大小比较规律中有一条:原子核外电子排布相同,核电荷数越大半径越小。水分子中存在氢键,其沸点反常。
【易错题2】短周期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<b<c<d< font="">
B.四氧化三铁与B的反应是工业上大量生产铁的重要方法
C.D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
D.B的氧化物是酸性氧化物,可溶于氨水
『错解分析』错选A或D,依据题中信息,A,C原子原子序数相差8,可知道A,C同主族,且原子半径:C>A,又B原子最外层电子数等于A原子最外层电子数的一半也是C原子半径一半,C原子最外层电子数多于A,所以B<c< font="">,故选A;错选D,由题中信息可看出B为Al,其氧化物为Al2O3,可溶于氨水,故选D。
『正确解答』出现错选A或D原因有二,一是不知道如何利用题目所给信息推导A,B,C,D为何物质,二是原子半径大小比较规律不熟悉,元素周期律很生疏。比较酸性一定要强调最高价氧化物的水化物,所以答案选C。
『规律小结』做此类试题,要掌握元素周期律的实质,了解元素周期表的结构(周期、族)及其应用,掌握同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系,了解化学键的定义,了解离子键、共价键的形成。
专题八 有机化学【易错题1】下列有关实验的叙述正确的是( )
A.用5mol/LH2SO4与乙醇共热制乙烯时要控温于170℃,且要加碎瓷片以防暴沸
B.乙炔有特殊气味是因制乙炔时电石中混有硫化氢和磷化氢
C.用高锰酸钾酸性溶液可以鉴别甲苯和苯,但溴水不能区分它们
D.将乙炔通入过量的浓溴水,生成1,2- 二溴乙烷。
『错解分析』错选A、B。制乙烯要使用乙醇和浓硫酸,浓硫酸的浓度约“18mol/L”,但选项中为“5mol/L”,A不正确。B选项所述乙炔的特殊气味,是其中混有硫化氢和磷化氢等气体杂质。这些杂质的产生是电石中混有少量的硫化物、磷化物。电石与水反应生成乙炔的同时,能与水反应生成硫化氢、磷化氢的硫化物、磷化物参与反应而产生杂质气体的。B不正确。
『正确解答』C正确,有侧链的甲苯和无侧链的苯,均不使溴水因反应而褪色,却把溴萃取至油层,且油层均比水轻浮于水面。酸性高锰酸钾溶液不与苯反应,却能将甲苯氧化为苯甲酸,而使高锰酸钾酸性溶液褪色。D错误,乙炔与溴反应生成1,1,2,2- 四溴乙烷。
『规律小结』此类题型常常因审题不细和有个别知识缺陷而导致出错率极高,且个别选项似对非对很易误导,所以在以后的学习中要认真研读每一个细节,力求知识的准确性。
【易错题2】下列卤代烃在NaOH醇溶液中加热不反应的是
①C6H5Cl②(CH3)2CHCH2Cl③(CH3)3CCH2Cl④CHCl2-CHBr2

A、①③⑥ B、②③⑤ C、全部D、②④
『错解分析』忽略卤代烃消去反应的实质,分子中与连接卤素原子的碳原子相邻的碳原子上没有氢原子的卤代烃不能发生消去反应。
『正确解答』(CH3)3CCH2Cl不能发生消去反应;CH2Cl2也不能发生消去反应,因其分子中只有一个碳原子。此外C6H5Cl若发生消去反应以后,将破坏苯环的稳定性,故C6H5Cl也不能发生消去反应。答案为A。
『规律小结』理解有机反应,要注意反应的实质:卤代烃消去反应时,断裂的是碳卤键和碳氢键,且不在同一个碳原子上,而是在两个相邻的碳原子上,因此并不是所有的卤代烃都能发生消去反应。不能发生消去反应的卤代烃有两类:①只有一个碳原子的卤代烃,如CH3Cl;②与连接卤原子的碳原子相邻的碳原子上没有氢原子的卤代烃,如CH3)3CCH2Cl。
专题九 电离平衡及盐类水解【易错题1】Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
A.[Na ]>[S2-]>[OH-]>[HS-]>[H ]
B.[Na ] [H ]==[S2-] [HS-] [OH-]
C.[Na ]==[HS-] 2[H2S] 2[S2-]
D.[OH-]==[H ] [HS-] [H2S]
『错解分析』错选BD。
本题有如下两个等式:
物质守恒:[Na ]==2[HS-] 2[H2S] 2[S2-] ①
电荷守恒:[Na ] [H ]==2[S2-] [HS-] [OH-] ②
在物质守恒中,应该找出该元素可能转化生成的各种微粒。如本题的硫元素,它来源于Na2S中的S2-,少量的S2-要水解转化成HS-,微量的HS-进一步水解转化成H2S,虽然生成H2S的量很小,很小,但在理论上不能没有。另外,含硫元素的各种微粒与钠离子的物质的量之比应符合原化学式中各微粒的比值。选项C违背了上述要求。在电荷守恒中,如何计算带多个单位电荷的微粒所带电量,往往容易出现误解。从表面形式上看,该微粒已带多个单位电荷,若用其所带电荷数乘以其浓度,似乎远远大于实际所带电量。实际上浓度只表示该微粒在单位体积里其物质的量(微粒)的多少,并不表示它带电量的多少。用其所带电荷数乘以其浓度,恰好计算其所带电量。选项B即错在此处。
由上述两个等式,通过代入变换,还可得到多个其他形式的等式。如②-①的整理得:[OH-]==[H ] [HS-] 2[H2S],可判断选项D是错误答案。
『正确解答』选项A,可以半定量地分析得出结论。假设Na2S的浓度为0.1mol·L-1,则[Na ]为0.2mol·L-1;硫离子少部分发生水解,其平衡浓度比0.1mol·L-1小,而水解生成硫氢根离子和氢氧根离子的浓度远远小于0.1mol·L-1(仍大于0.001mol·L-1);由于硫氢根离子受到一定浓度的氢氧根离子影响(抑制其水解),其还要发生微弱的水解(存在电离和水解两种趋势,但水解趋势大于电离趋势),这样氢氧根离子的浓度将大于硫氢根离子的浓度;溶液呈碱性,其[H ]将由水的离子积和[OH-]求出,很明显其浓度远远小于[HS-](其与[OH-]在同一数量级上)。
『规律小结』电解质的水溶液中一定存在两个守恒:①物质守恒,②电荷守恒。通俗的说:①各种元素的微粒既不可增加也不可减少;②电解质溶液中存在各种带电的微粒,但所带电量的代数和等于零,即溶液不带电。
【易错题2】某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
『错解分析』错选B或C或D,原因一等体积的NaOH溶液和CH3COOH溶液混合后溶液中恰好含有Na+、CH3COO-、H+、OH-故选B,原因二,溶液中由电荷守衡知:c(CH3COO-) c(OH-)=c(Na+) c(H+),加入适量的NaOH,可使溶液显碱性所以B正确;原因三加入适量的氨水溶液中有c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(CH3COO-)>c(NH4+)+c(Na+)所以D正确。
『正确解答』此题的关键应注意题中的“酸性”两个字,选B就因为忽略了“酸性”两个字,分析不透,只注意c(OH-)>c(H+)而忽略了c(CH3COO-)>c(Na+)不论在什么情况下都是错误的。选项B溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性;选项C中当加入NaOH后溶液仍然呈酸性,则c(H+)>c(OH-),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(CH3COO-),当碱过量时,必定c(Na+)>C(CH3COO-),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(CH3COO-)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(CH3COO-)=c(NH4+)+c(Na+);当溶液呈碱性时,c(H+)<c(OH-),则c(CH3COO-)<c(NH4+)+c(Na+),所以c(CH3COO-)不一定大于c(Na+)、c(NH4+)之和。
『规律小结』做此类试题要明确以下几点:
(1)确定溶液中的溶质成分及各自的物质的量浓度大小是溶液中离子浓度大小比较的前提。
(2)一般盐完全电离的离子浓度>其离子水解或电解而产生的离子浓度>与溶液性质(酸性或碱性)相反的离子。
(3)在微粒浓度的大小比较中,等式常与电荷守恒、物料守恒相联系,出现的等式若不是两个守恒式,则把两个守恒式相互叠加,加以推导即可判断。
专题十实验题【易错题1】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用图2-1-7所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
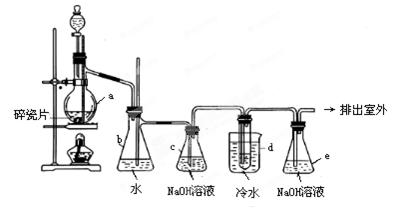
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
(3)容器c中NaOH溶液的作用是:_________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。
『错解分析』
第(1)问:


第(2)问:①液面下降,水柱上升,水被压出瓶b。②c中NaOH倒流入b,使液面上升,c中气体倒流造成b压强增大,长导管倒吸。③液面沿玻璃棒上升;液面沿玻璃试管上升;液面沿温度计上升;④产生红棕色气体。
第(3)问:①去杂,除气。②去除H2SO4,HBr,乙酸,Br2等。③去除H2SO4分解或蒸发出的SO2,SO3。④干燥,吸水。
第(4)问:①只答“有副反应进行,生成乙醚”。②装置不当,造成乙烯逸出,不能与溴充分反应,如乙烯的导管未插入液溴中。③液溴中有水,使浓度变稀,故与乙烯反应不完全。④乙烯与水反应生成乙醇而消耗。⑤温度过高,乙醇挥发。
第(1)问:出现①误区,是由于未注明反应温度是170℃,CH2=CH2是气体,未标“↑”符号,导致失误。出现②误区,是由于标明的温度不对,140℃乙醇发生分子间脱水,生成乙醚,得不到乙烯,导致失误。另一个失误是C2H4是乙烯的分子式,乙烯的结构简式为CH2=CH2,希望引起大家的重视,严格区分结构简式和分子式。出现③误区,是由于出现了“水浴”这两个字,导致失误。众所周知,沸水浴温度为100℃,达不到170℃。出现④误区,是由于标明的“

第(2)问:出现①误区,是由于未答出什么地方液面下降?什么地方水柱上升?属于文字表达不准确所致。出现②误区,是由于不会运用已有知识分析安全瓶b的作用,不知道当d堵塞时,支管锥形瓶中的气体无法进入c瓶,导致b瓶中气体压强增大,使b中水面下降,水被气体压入竖直的玻璃管中,甚至从玻璃管上端溢出,导致失误。出现③误区,是由于看不懂题意,误将直立的玻璃管看成了玻璃棒、玻璃试管、温度计。说明有些同学不懂反应原理,不会分析安全瓶内的压强变化,导致失误。出现④误区,是由于不知道溴在水封时,是难于挥发,也难于逆向而行的,导致失误。
第(3)问:出现①误区,是由于未能指明是酸性气体,回答不确切所致。出现②误区,是由于对H2SO4的性质、CH3CH2OH与浓H2SO4反应可能发生的副反应不清楚,导致失误。出现③误区,与②误区原因相似,这里要提醒大家的是H2SO4是高沸点酸,在170℃不会挥发,也不会分解。出现④误区,是由于不懂c装置的作用,不知道NaOH溶液不可能用来干燥气体,造成失误。
第(4)问:出现①误区,是由于未答出根本原因是“控温不当”,且漏答了另一个原因是“产生乙烯的速率过快”,不能通过对一整套实验的综合分析推理,解释实验中的异常情况,导致失误。出现②误区,是由于未审明题意,本题一整套装置设计严谨,不存在“装置不当”问题,导致失误。出现③误区,是由于不懂得液溴中水封的作用所致。出现④误区,是由于忽略了乙烯与水加成的条件,不能抓住“控温不当”和“速率”快慢两个要点对实验中的异常情况做出解释,造成失误。出现⑤误区,是由于未答出温度过高,使乙醇炭化,消耗了乙醇,造成失误。
『正确解答』观察在实验室里制备1,2-二溴乙烷的装置,其连接顺序是:制取乙烯装置→安全瓶b→气体净化装置→乙烯与溴加成的反应器→尾气处理装置。头脑中立即浮现气体综合实验的知识框架:

二者的差别有两点:第一,前者新增加了安全瓶b,题目明示,它的作用是防止倒吸,并可以检查实验进行时试管d是否发生堵塞。第二,乙烯与液溴(表面覆盖少量水)反应,不需要将乙烯干燥。通过仔细阅读题目要求,迅速从大脑中提取下列知识:①两个化学方程式:乙醇分子内脱水生成乙烯;乙烯与溴加成。②在制取乙烯的实验中,由于控温不当,若不能迅速达到170℃,可能有乙醚生成;若温度过高,乙醇与浓硫酸反应生成二氧化碳、二氧化硫、水蒸气和炭黑,使烧瓶中液体变黑。③乙醇制乙烯时,反应速率很快。④混在乙烯气体中的CO2,SO2,可用NaOH溶液洗气除去。以便应用这些知识回答有关问题。对安全瓶b的作用,题目已经给出,要求叙述d堵塞时,瓶b中的现象,可按支管锥形瓶中气体无法进入c瓶来分析,便知b瓶中气体压强增大,致使b中水面下降,水被气体压入竖直的玻璃管中,甚至溢出。答案:

CH2=CH2 Br2→CH2BrCH2Br
(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。
(3)除去乙烯中带出的酸性气体。或答除去CO2、SO2。
(4)原因:①乙烯发生(或通过液溴)速度过快;②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当”亦可)。
『规律小结』解答此类试题要掌握以下分析方法:
-
实验目的,2.实验用品,3.实验装置,4.实验步骤, 5.核心问题。
【易错题2】用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
选项
操作及现象
溶液
A
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。
C6H5ONa溶液
B
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。
Na2SiO3溶液
C
通入CO2,溶液变浑浊。再加入品红溶液,红色退去。
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。
Ca(OH)2溶液
『错解分析』错选C。认为将CO2通入Ca(ClO)2溶液中会发生CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,没有可以使品红褪色的物质,忽略了反应生成的HClO具有强氧化性,在向溶液中滴加品红溶液时,红色将退去。
『正确解答』将CO2通入C6H5ONa溶液中会发生CO2+H2O+C6H5ONa

『规律小结』化学试验题目的形式多样,可以是选择题,也可以是推断题、实验简答题;考查点也比较灵活,可以是粒子的检验、物质的检验,也可以以元素化合物的性质为基础,以化学试验为基本操作对材料的组织和语言表达能力为主线进行考查。特别要关注操作步骤及实验现象。
以上就是今天化学姐给同学们推荐的易错题总结啦,有需要的同学分享给朋友吧。不要忘记给化学姐留言哦~


免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com