化学反应速率和限度计算题(化学反应的快慢和限度随堂练习题)
一、选择题(在每小题列出的四个选项中,只有一个选项是最符合题目要求的。)
1、高炉炼铁中发生的基本反应为Fe2O3 3CO ===2Fe 3CO2,为更快更好的生产出优质钢材,下列提高反应速率的措施不可行的是 ( )
A、升高温度 B、建容量大的高炉,增大原料的投入量
C、增大CO的浓度 D、将铁矿石粉碎,尽可能用小块的铁矿石
2、为改善空气质量,我国各地政府出台了机动车单双号限行的措施。已知NO和CO是汽车尾气中的主要有害物质,它们能缓慢反应生成N2和CO2:NO+CO=(可逆号)N2+CO2。有关该反应的下列叙述正确的是 ( )A、使用催化剂可加快反应速率 B、降低压强使反应速率加快C、改变压强对反应速率无影响 D、改变温度对反应速率无影响
3、氢气是一种很好的环保能源,把Zn粒放入到盛有稀盐酸的容器中就可以得到H2,下列有关H2产生快慢的说法错误的是 ( ) A、该加浓盐酸,H2产生的速率一定加快
B、加热溶液,H2产生的速率不一定加快
C、增加Zn粒的数量,H2产生的速率一定加快
D、将Zn粒改为足量Zn粉,H2产生的速率一定加快
4、一定温度下,在固定容积的密闭容器中发生下列反应:2HI=(可逆号)H2 I2(g)。若HI的浓度由0.1mol・L-1降到0.07 mol・L-1时需要15s,则HI的浓度由0.07mol・L-1降到0.05 mol・L-1时,所需时间为 ( )A、等于5s B、等于10s C、大于10s D、小于10s
5、 将4molA气体和2molB气体充入2L密闭容器中混合,在一定条件下发生如下反应: 2A(g) B(g)=(可逆号)2C(g)。若2min后测得C的浓度为0.6mol·L-1,则下列说法中不正确的是 ( ) A、如果开始时增大压强,则2min后C的浓度一定小于0.6mol·L-1
B、物质B表示的反应速率为0.15mol・L-1・min-1C、2min时物质A的转化率为70%
D、2min时物质B的浓度是0.7mol・L-1
6、设吸热反应C CO2=(可逆号)2CO的反应速率为V1、放热反应N2 3H2=(可逆号,高温、高压、催化剂)2NH3的反应速率为V2,当温度升高时,V1和V2的变化情况为 ( )
A、 都增大 B、 V1增大,V2减小
C、 都减小 D、 V1减小,V2增大
二、填空题
7、在生活中,正确运用化学反应速率知识会提高我们的生产效率和生活质量。在下列事实中,是什么因素影响了化学反应速率呢?请把正确结果填在横线上:(1)同样的食品冬天不易发生霉变,而夏天需要放在冰箱里保存:__________。(2)制取氧气时,只用熔融的KClO3放出气泡会很慢,撒入少量MnO2后会很快产生大量气体:______________________________。(3)硫酸工业中,需先将固体原料黄铁矿粉碎,然后装入反应器沸腾炉:_____________(4)同浓度、同体积的硫酸溶液和盐酸溶液与外观相同且质量一样的锌粒反应时,产生气体的速率有快有慢:____________。
8、水煤气是我们生活里常用的燃料,制取该燃料的原理为:C H2O(g)=CO H2。在某条件下,在实验室里将净化后的固体碳和水蒸气置于一反应器中进行研究,请根据所学知识讨论下列条件下该反应速率的变化(填“增大”、“减小”或者“不变”):
(1)将容器体积压缩为原来的2/3,反应速率_____;
(2)恒温、恒容时,充入惰性气体Ar,反应速率_____;
(3)恒温、恒压时,充入惰性气体Ar,反应速率_____;
(4)为提高反应速率,反应物碳最好选择_____ 。
9、一定温度下,在2 L密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。则反应开始到10s时:

(1)用Z表示的反应速率为_____ ;(2)Y的转化率为_____ ;
(3)反应的化学方程式为_______________ 。
三、实验题
10、已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃。李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
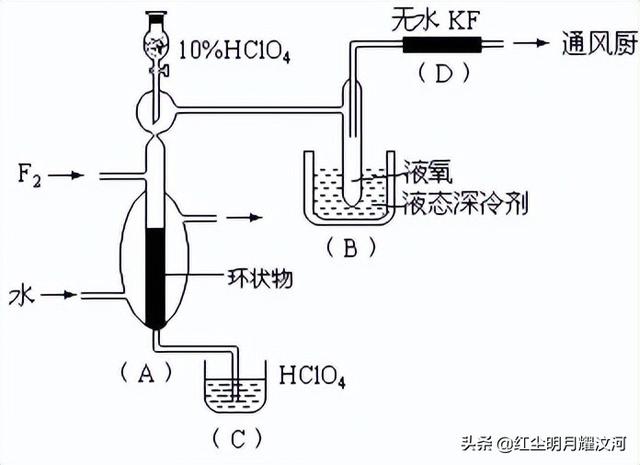
(1)实验中生成X的化学方程式是____________________ ;(2)现有10%和30%的HClO4,李明最好选用_____ ,理由是_______________ ;(3)B中冷却剂选用液氧的理由是_________________________ ;(4)A中填充环状物的作用是________________________________________ 。

【答案】
1、B 2、A 3、D 4、C 5、A 6、A
7、答案:(1)夏天温度高、冬天温度低,温度越高, 食品越易发生霉变。
(2)MnO2是KClO3分解生成O2的催化剂,加入催化剂可以大大提高化学反应速率。
(3)将固体原料黄铁矿粉碎后可增大原料与空气的接触面积,提高化学反应速率,从而提高原料利用率。
(4)该反应的实质是Zn+2H+=Zn2++H2↑,而同浓度的硫酸溶液比盐酸溶液中H+浓度大,因而在H2SO4中反应快。
8、答案:(1)增大(2)不变(3)减慢(4)碳粉
9、(1)0.158mol·L-1·s-1;(2)79.0%;(3)X(g) Y(g)=(可逆号) Z(g)。
10、答案:(1)HClO4 F2=ClO4F HF (2)30%的HClO4,浓度增大,反应速率加快;(3)因为液氧提供的低温可以使ClO4F 成为固体,便于ClO4F 的分离;(4)增大F2与HClO4的接触面积,以提高反应速率,有利于反应朝预定方向进行。

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






