重排的后果(重排反应汇总)
重排反应是有机合成中很常见的一类反应。按反应机理,重排反应可分为:基团迁移重排反应和周环反应。
基团迁移重排反应反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。常见的迁移基团是烃基。这类反应又可按价键断裂方式分为异裂和均裂 ,前者重要得多,其中尤以缺电子重排最为重要。
周环反应反应物因分子内共价键协同变化而发生重排的反应,有电环化反应和δ迁移反应。
下面对本公众号已经发布过的重排反应进行汇总,便于小伙伴们查找学习。点击反应标题可以查看详细内容。
一、Amadori重排反应

酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
二、Baker-Venkataraman重排
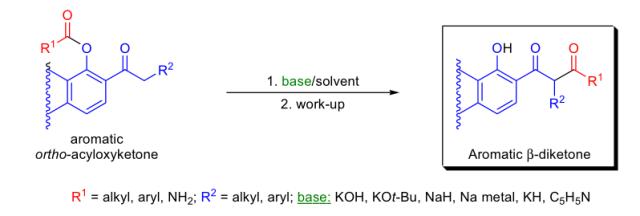
碱催化下邻酰氧基芳基酮重排得到相应的芳基β-二酮的反应被称为Baker-Venkataraman重排。β-二酮是非常重要的合成中间体,其可以用于合成色酮,黄酮,异黄酮和香豆素等。
此反应中常用的碱有:KOH, 叔丁醇钾的DMSO溶液,金属钠在甲苯中反应,KH或NaH,吡啶,三苯甲基钠。
三、Bamberger重排

N-苯基羟胺在酸作用下重排为4-氨基苯酚的反应。


在酸催化下肟重排得到酰胺的反应,此反应与霍夫曼反应,Schmidt反应和Curtius 重排类似,反应中会形成带正电的氮原子,然后发生烷基迁移。
五、Brook重排反应


该反应是1958年加拿大的化学家Brook发现报道的。α-硅基氧负离子通过生成一个五配位硅中间体重排得到α-硅氧基碳负离子的反应称为[1,2]-Brook重排,或[1,2]-硅基迁移。后来发现此类硅迁移反应普遍存在,因此[1,n]-硅基由碳原子迁移到氧原子的反应统称为Brook重排。
六、Boulton–Katritzky重排

加热条件下五元杂环重排和与其相连的三原子链重新生成新的五元环的反应。
七、Boyer-Schmidt-Aube重排(Boyer-Schmidt-Aube Rearrangement)

叠氮与羰基化合物在路易斯酸的存在家发生重排,最终形成相同碳数酰胺的反应。该反应经常被用于通过分子内反应合成生物碱骨架。
八、Carroll重排

此反应是克莱森重排反应的变体,β- 酮酸烯丙酯通过阴离子辅助克莱森重排后脱羰基得到γ,δ- 不饱和酮的反应。
在Pd或者Ru催化的条件下,该反应能在温和的条件下进行,并且经常也被用于不对称中心的构建【Shimizu, I.; Yamada, T.; Tsuji, J. Tetrahedron Lett.1980, 21, 3199. DOI:10.1016/S0040-4039(00)77444-2】。丙二酸烯丙基酯也能作为该反应的底物。
Chan酰氧基乙酸酯重排反应
强碱性条件下,酰氧基乙酸酯经过环氧化物中间体,重排生成2-羟基-3-酮酯的反应。产物可以进一步氧化得到α,β-二酮酯。
九、查普曼重排反应(Chapman Rearrangement)

O-芳基亚胺酯经过重排转化成芳香胺的反应。
十、Ciamician–Dennstedt重排


吡咯在强碱条件下与卤仿(CHX 3 where X = Cl, Br, I)反应重排生成3-卤代吡啶的反应。此反应是由G.L. Ciamician在1881年首先发现,后来M.Dennstedt利用甲醇钠催化吡咯和二碘甲烷反应制备得到吡啶,使此方法的应用范围更加广泛。后来在此研究的基础上,利用吲哚和喹啉的方法也被发现。因此此类反应都统称为Ciamician-Dennstedt重排反应。
此反应也会被看成非常规的Reimer-Tiemann反应。
十一、Claisen重排反应

Claisen重排反应是由Rainer Ludwig Claisen在1912年发现,是第一个被发现的[3,3]-σ迁移重排。此反应是强力生成碳碳键的反应,加热烯丙基烯基醚通过[3,3]-σ迁移重排生成γ,δ-不饱和羰基化合物的反应。另外对位-Claisen重排, Belluš–Claisen r重排; Corey–Claisen反应, Eschenmoser–Claisen重排, Ireland–Claisen反应, Kazmaier–Claisen反应, Saucy–Claisen反应; orthoester Johnson–Claisen反应和Carroll重排都属于这个系列的反应。Claisen重排反应是协同反应。
十二、Ciamician–Dennsted重排

吡咯和氯仿在氢氧化钠存在下反应制备3-氯吡啶的反应。
十三、Cope重排反应

反应属于[3,3]-σ单电子迁移重排,反应过程协同进行,反应可逆。机理同克莱森重排。
十四、康福斯重排反应(Cornforth Rearrangement)

4-位有羰基取代基的恶唑在加热条件下发生重排,噻唑也同样有相似的重排反应发生。
由澳大利亚化学家John Cornforth(1917-)(1975年获化学诺奖) 在1949年首先报道。
十五、Curtius 重排

酰基叠氮加热进行1,2-C-N迁移并放出氮气,生成异氰酸酯的反应被称为Curtius重排。反应中原位生成的异氰酸酯和各种亲核试剂反应,可以得到氨基甲酸酯,脲等各种N-酰基衍生物。也可以直接水解得到伯胺。
十六、Curtius 重排合成胺及其衍生物

Curtius重排是一种常用的将羧酸转化为少一个碳的胺及相应衍生物的方法。
十七、Demjanov重排

一级胺转化为重氮化合物中间体经过C-C键迁移得到醇的反应。
十八、Dimroth重排反应


杂环化合物的环内或环外杂原子和其取代基之间通过开环-关环交换位置异构化的反应被称为Dimroth重排。B. Rathke在进行三嗪类化合物研究时首先发现了此类重排,但其没有对其机理进行解释。1909年,O. Dimroth提出了三氮唑类化合物的重排机理。上世纪50年代中期发现嘧啶类化合物也普遍存在此重排反应。再到后期更多此重排反应被发现,许多含有氮原子的杂环都可以进行Dimroth重排。1963年,D.J. Brown和J.S. Harper发现了热催化的Dimroth重排。
十九、Di-π-methane重排(Di-π-methane Rearrangement)

在光照射下二烯发生重排,得到乙烯基环丙烷的反应。在含有杂原子如O或者N,或者含有苯环取代基的底物也能进行该反应。
二十、Dyotropic重排反应(dyotropic rearrangement)

两个σ键发生协同性的组合变化进行的重排反应被称为dyotropic rearrangement
标题图上部所示的被称为I型dyotropic rearrangement,也就是两个σ键重排后,取代基位置互换。而下部的被称为II型dyotropic rearrangement,重排后两个取代基相对位置不发生变化。
二十一、Eschenmoser–Claisen酰胺缩酮重排

N,O-乙烯酮缩酮进行[3,3]-单电子重排得到γ,δ-不饱和酰胺的反应。由于Eschenmoser是基于Meerwein对于酰胺交换的研究而发现此反应,此反应也被称为Meerwein–Eschenmoser–Claisen重排。
二十二、Favorskii重排
可以烯醇化的α-卤代酮在烷氧基,羟基或胺催化下重排分别生成酯,羧酸或酰胺的反应。

环状底物的Favorskii重排


在Lewis酸催化下O-取代的烯糖衍生物通过烯丙位重排与O-, S-, C- N-, P-和卤代亲核试剂反应得到2,3-不饱和糖苷类化合物的反应。1914年Emil Fischer在水中加热三-O-乙酰基-D-烯糖时发现了此反应。后来经过Robin Ferrier等人的系统研究,扩展到O-, S-, C- N-, P-和卤代等亲核试剂。通常情况下,此类反应要用路易斯酸催化,三氟化硼乙醚是最常用的催化剂,另外InCl3,SnCl4,ZnCl2等也会用于此反应。常用溶剂有:二氯甲烷和甲苯等。生成的糖苷化合物主要是直立键产物(α:β=7:1)。

路易斯酸催化下一锅法高效地将5,6-不饱和呋喃糖转化为取代环己酮类化合物的反应。此反应也被称为Type II Ferrier rearrangement(与之相对的Ferrier重排反应-Type I Ferrier reaction),此反应可以用于合成手性的肌糖类化合物,如胺基肌糖,脱氧肌糖,不和肌糖,选择性-O-取代肌糖和肌糖膦酸酯等等。
反应底物可以很容易通过糖类合成,进而合成各种手性多取代的环己酮类化合物。大多数反应,可以高产率的得到非对映异构体。路易斯酸只需要催化量,因此此反应中酸敏感的复杂化合物不受影响。
二十四、Fries重排

Lewis酸催化下酚酯或酚酰胺重排得到2-或 4-酮基苯酚的反应。也被称为Fries-Finck重排。
二十五、Fritsch–Buttenberg–Wiechell重排反应

1,1′-二芳基-2-溴代烯烃在BuLi等强碱作用下发生α消除、通过卡宾重排形成炔烃的反应。
二十六、Gabriel–Colman重排

芳基邻二酰亚胺基乙酸酯在碱性条件下重排得到1,4-二酚异喹啉类似物的反应。
二十七、Hofmann重排

伯胺的酰胺通过次卤化物处理经过异氰酸酯中间体生成相应的伯胺的反应。
二十八、Lossen重排

碱处理O-酰基羟肟酸重排得到异氰酸酯的反应。
二十九、[1,2]-Meisenheimer重排

叔胺的N-氧化物通过[1,2]-σ单电子重排得到O-取代羟胺的反应。
[2,3]-Meisenheimer重排

烯丙基叔胺的N-氧化物通过[2,3]-σ单电子重排得到O-烯丙基羟胺的反应。
三十、Meyer–Schuster重排

通过1,3-迁移α-炔基仲醇或叔醇异构化得到α,β-不饱和羰基化合物的反应。当炔基是端基炔时,产物是醛,而非端基炔则为酮。此反应机理与Rupe重排类似。
三十一、Mislow–Evans重排反应

烯丙型亚砜在P(OMe)3存在下加热,发生[2,3]-σ-单电子重排,得到次磺酸酯,进而在P(OMe)3作用下转化为烯丙醇的反应。此反应立体选择性高。

此反应也可以利用烯丙位硫醚为底物,通过氧化,重排一锅法得到烯丙醇类产物。常见的氧化剂有高点酸钠,MoO5-Pyr-HMPA(MoOPH)和mCPBA。此反应的E:Z选择性和取代基的大小有关,取代基越大,选择性越好。
三十二、Neber重排反应

1926年,在贝克曼重排反应的研究期间,P.W. Neber和A. Friedolsheim发表报道:甲苯磺酸酮肟在乙醇钾,乙酸和盐酸的作用下得到氨基酮的盐酸盐。在碱诱导下由o-酰化酮肟重排生成相应的α-氨基酮的反应称为Neber重排。此反应成为以氨基酮为前体的杂环化合物的合成的一个重要合成工具。
三十三、Overman重排

通过烯烃的1,3-位置互换将烯丙基三氯乙酰亚胺酯转化为烯丙基三氯乙酰胺进而将烯丙醇转化为烯丙胺的反应。
三十四、Payne重排

在碱性条件下2,3-环氧醇类化合物异构化得到1,2-环氧-3-醇的反应。此反应也被称为环氧迁移反应。
三十五、Pinacol重排

酸催化下邻二醇(频哪醇)重排得到羰基化合物的反应。
重排时富电子基团(更多取代基)更容易迁移,一般的迁移顺序为:
叔烷基 > 环己基 > 仲烷基 > 苄基 > 苯基 >
伯烷基 >甲基 >> H.
取代芳基的迁移顺序:
p-MeO-Ar > p-Me-Ar > p-Cl-Ar > p-Br-Ar > p-O2N-Ar。
三十六、Pummerer重排

1909年,R. Pummerer发现在无机酸(如盐酸,硫酸)存在下加热苯基亚磺酰基乙酸可以得到苯硫酚和乙醛酸。后来发现此反应在各种此类化合物中普遍存在,因此现在通过亚砜转化为相应的α-取代硫醚的反应被称为Pummerer重排。
三十七、Ramberg-Backlund重排

1940年,L. Ramberg和B. Backlund发现了一个非常有趣的反应,在此反应中用沸腾的氢氧化钾水溶液处理1-溴-1-乙烷磺酰基乙烷(α-溴砜)可以得到(Z)-2-丁烯。直到上世纪50年代,F.G. Bordwell及其团队通过大量的实验论证,终于阐明了此反应的机理。通过碱引发α-卤代砜经由一个三元环砜中间体重排为烯的反应称为Ramberg-Backlund重排。
三十八、Rupe重排

酸催化下α-炔基叔醇重排生成α,β-不饱和酮的反应。此反应机理和Meyer-Schuster重排类似,但α-乙炔基叔醇则得到α,β-不饱和醛而不酮。Meyer-Schuster重排的反应条件比较温和,而Rupe重排一般是在回流状态下反应。
三十九、smile重排反应
分子内的芳香亲核重排反应。

四十、Sommelet–Hauser重排

苄基季铵盐在氨基碱金属化合物的作用下得到铵叶立德中间体,接着进行[2,3]-Wittig重排生成邻甲基苄胺的反应。
四十一、Schmidt重排

Schmidt反应是指酸催化下叠氮酸或叠氮化合物和亲电试剂(羰基化合物,叔醇和烯烃)反应重排放出氮气得到胺,腈,酰胺或亚胺的反应。

β-胺基醇重氮化通过碳正离子重排C-C迁移得到羰基化合物的反应。
此反应适用于制 C5~C9 环,尤其是 C5~C7 的环酮。反应底物可由相应的环酮与氰化氢加成后再还原得到,因此该反应是从低级环酮合成多一个碳的高级环酮的一种方法。
四十三、Truce-Smile重排

此反应是Smile重排中Y为碳原子的特殊情况。
四十四、Wagner–Meerwein重排

酸催化下醇的烷基进行迁移得到多取代烯烃的反应。
四十五、[1,2]-Wittig重排

利用烷基锂处理醚重排得到醇的反应。
四十六、[2,3]-Wittig重排

碱处理烯丙基醚重排得到高烯丙醇的反应,也被称为Still-Wittig重排。反应机理同Sommelet-Hauser重排类似。
四十七、Wolff重排
α-重氮酮重排得到烯酮的反应。烯酮是非常重要的有机中间体。可以和水反应制备羧酸,和醇反应制备酯,和胺反应制备酰胺,发生Staudinger烯酮环加成合成各种四元环化合物(可以和烯烃,醛酮和亚胺进行[2 2]环加成得到环丁酮,β -内酯和β -内酰胺)。
四十八、Zinin联苯胺重排

酸催化下氢化偶氮苯重排得到4,4-二氨基联苯 (benzidine)和2,4-二氨基联苯的反应。
四十九、Zimmerman重排

1,4-二烯类化合物在光照条件下转化为烯基环丙烷的反应。也被称为双-π-甲烷重排(Di-π-methane rearrangement)。
五十、乙烯基环丙烷-环戊烯重排

乙烯基环丙烷通过双自由基中间体转化为环戊烯的反应。
五十一、二苯乙醇酸重排反应

苯偶酰通过苯基重排得到二苯基乙醇酸的反应。
五十二、Lu-Trost-Inoue反应

炔酮或炔酯在过渡金属催化剂或叔膦的催化下异构成E, E构型的共轭二烯酮的反应。
1988年,陆熙炎小组首先报道了一个钌(II)催化下炔酮异构化为共轭二烯酮的反应,反应生成的产物为E,E 构型。其后Trost小组(钯催化)和Inoue小组(钌催化)也分别报道了此类反应。陆熙炎小组在后续研究中发现,铱(III)【IrH3(i-Pr3)2】催化性能更好。另外加入催化量的叔膦,可以将反应温度降低至35℃。利用铱-三丁基膦作为催化剂,陆熙炎小组在80℃下实现了炔酸酯的异构化反应。另外单独的三烷基膦或三芳基膦可以催化此反应【J. Am. Chem. Soc., 1992, 114 (20), pp 7933–7935】。
五十三、Mamedov杂环重排反应
酸催化下喹恶酮衍生物和N-取代亲核试剂反应得到螺环喹恶酮中间体,重排得到2-杂环取代的苯并咪唑的反应。
五十四、Berchtold烯胺扩环反应

乙炔酯对环烯胺进行环加成,接着重排扩环,得到多两个碳的环二烯胺的反应。产物水解后可以得到多两个碳的环二烯酮。
五十五、Brandi-Guama螺环丙烷重排反应

腈氧化物或硝酮对甲叉基环丙烷进行[3 2]-偶极环加成得到异恶唑烷-5-螺环丙烷,接着加热或光照重排生成4-吡啶酮衍生物的反应。腈氧化物作为底物则生成不饱和吡啶酮衍生物,硝酮则生成4-哌啶酮。
五十六、Bamberger咪唑合成
咪唑和酰氯反应环裂解为烯二胺酰胺中间体,接着加热得到2-取代咪唑的反应。
五十七、二烯酮苯酚重排

4,4-二取代环己二烯酮在酸催化下重排为 3,4-二取代苯酚的反应。
五十八、Stevens rearrangement

在强碱作用下与氮相连的碳中有一个碳连有吸电子基团的季铵盐重排得到叔胺的反应。返回搜狐,查看更多
声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com