化学四大平衡知识点(高中化学知识难点讲解)

所谓绝热就是指反应体系与外界没有热量交换,即热传递交换为0。实际上,绝热条件在化学平衡中的主要影响因素就是温度。因为几乎所有的化学反应均伴随着热能的释放与吸收,反应的吸、放热没有与外界交换,就影响着平衡体系中的温度变化,从而促使平衡发生移动。
例1.一定条件下存在反应:
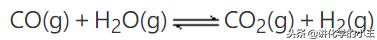
其正反应放热。现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2和1mol H2,在III中充入2mol CO和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的多
D.容器I中CO的转化率与容器II中CO2的转化率之和小于1
解析:这是一道考查学生对速率与平衡常数等概念的理解、对平衡移动和转化率等知识理解的难题。容器是恒容的绝热体系,与外界没有热量交换。容器I、III从正向开始反应达平衡,正反应是放热的,容器温度会升高。同时,容器III起始投料是容器I的两倍,故T3>T1>700℃,容器I、III中反应的平衡常数不相同:K1>K3,选项B错。容器II中从逆向开始反应达平衡,反应要吸热,容器温度会降低,即T1>700℃>T2。若是恒温,容器I和容器II完全等效,容器I中CO的转化率与容器II中CO2的转化率之和等于1,但由于是绝热体系,容器I升温,平衡左移,容器I中CO的转化率减小,CO的物质的量增多;而容器II降温,平衡右移,容器II中CO2的转化率减小,CO的物质的量减少,显然,容器I中CO的转化率与容器II中CO2的转化率之和小于1,选项D正确,容器I中CO的物质的量比容器II中的多,选项C正确。容器I、II中的温度不同,正反应速率也不同,容器I的反应速率要快,选项a错。
正确答案:CD
点评:绝热体系与外界没有热量交换,对化学平衡的影响就是温度的影响,只要化为改变温度使平衡移动,即可解决相关问题。
例2.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应

达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a-b段小于b-c段
解析:这是一个反应前后体积不变的可逆反应,由于容器恒容并绝热,因此压强不影响反应速率,只考虑温度和浓度的影响。由图示信息可以看出随着反应的进行,c点前的v(正)逐渐增大,而c点后v(正)反而减小。c点前随反应物浓度的减小,v(正)应该降低,但此时v(正)还升高,说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高,v(正)加快。选项C错。c点后v(正)反而降低,说明此时反应物浓度的影响是主要的,随着反应物浓度越来越小,v(正)逐渐减小。但c点v(正)最大,c点后v(正)还在降低,说明c点未达平衡状态,选项A、B均错。v(正)越快,消耗的二氧化硫就越多,选项D正确。
正确答案:D
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






