怎么理解熵增定律(熵是什么它有多重要)
我是戴森,一个热爱分享科学与汽车主题的科普人。
前几天我制作了一个视频,在里面介绍了一位伟大却悲情的物理学天才:玻尔兹曼,以及他墓碑上的熵公式的深远影响,感兴趣的同学,可以点下面的视频回顾一下。
视频毕竟不能太长,有很多想表达的东西感觉来不及说,所以今天补上一篇图文,咱们从热力学谈起,与大家分享一下,我眼中的熵理论以及它如何革新了人们认识世界与自身的方式!
正如在视频中我所说的,人们第一次遇见熵这个概念,是在热力学的第二定律中。当时从热力学分析中发现并命名了“熵”(Entropy)的是克劳修斯(下图中这个有点凶的老人),图中这句话,则非常精炼的描述了克劳修斯的两大成就,我们后面就说到他。

在介绍克劳修斯的成果之前,我们还得先回顾一下卡诺热机和卡诺定理,卡诺热机是一个工作在高低温热源之间的可逆热机,所谓可逆就是说它既能够从高温热源吸热到低温热源放热,也可以反着来,低吸高放。卡诺(下图)证明了,对于所有的在高低温热源之间工作的热机,可逆热机的效率最高,而且他给出了这个效率表达式,等于1减掉高低温热源温度之比(热力学温度)!

卡诺定理告诉人们,想让你的热机效率等于1吗?除非你找到一个绝对零度的低温热源,或者你的让高温热源温度无限高,可这两个条件哪个也不可能实现,因此制造一个100%热效率的热机是不可能的。
卡诺定理的背后,如果仔细想想,是有一点不寻常的意思在里面的,咱举个例子:我们有一个高温热源,我们想把热源的热量都用来推动一个机械做功,从常识来看,如果我的装置设计的足够精妙与严实,热源并不会向外界散失一点热量,那么热源的热量能够全部转换为功吗?
思考几秒钟……
如果没学过热力学的人,应该会说“没什么问题”吧,能量守恒嘛!但是!效率等于什么?做功与热量之比对吧(下图),若想让热全部转化为功,也就相当于要求效率等于1!而卡诺定理已经告诉你的是,除非你让低温热源处于绝对零度,否则是不可能的。你可能说这儿也没低温热源,不就一个热源吗?但热机工作是需要两个热源的,只不过本例中,低温热源就是周围的环境呀!所以除非你的装置在绝对零度的环境中使用并且温度保持不变,否则你就不可能让热量全部用来做功!
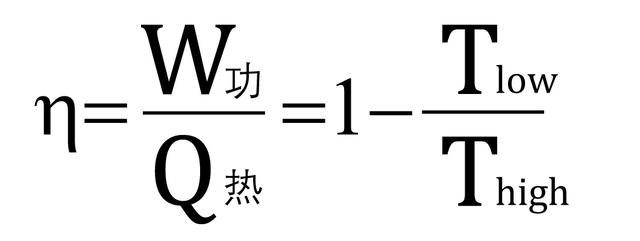
现在能明白,卡诺定理背后暗含的深意了吧?热,不能全部转换为功!接下来,我们可以请出克劳修斯了。
克劳修斯与热力学熵克劳修斯在1850年发表了一篇名为《论热的动力以及由此推出的关于热学本身的诸定律》的重要论文。简单来说,这篇论文主要阐述了两个问题:
第一,通过对热机工作过程的分析,明确表述了能量守恒定律,也就是我们熟悉的热力学第一定律,他说:在热机做功过程中,一部分热量转换为功以推动机械,另一部分则从高温物体传递到了低温物体;
第二,也是更重要的,他在卡诺循环基础上研究了能量转换和传递方向的问题,并由此提出了著名的热力学第二定律,准确地讲叫做热力学第二定律的克劳修斯表述,因为开尔文也独立的表述了热二律!克劳修斯说:热不能自动地从低温物体传到高温物体。
提醒大家,在克劳修斯的表述中,就暗含了一个关于“方向”的问题,热量只会自发的从高温到低温传递,而不是反过来,这是很重要的一点!
在此基础上,克劳修斯进一步在1856年定义了一个叫做“熵”的物理量,更明确的阐述了上面这种单向传递的过程,通俗的讲就是咱们常见的那一句话:“孤立系统的熵,永不减少”。
危机初显熵的概念一出世,大家都感到了不安,因为人们马上就联想到了我们所生活的这个宇宙,那时候人们普遍认为宇宙是一个孤立且封闭的系统,按照热力学第二定律,我们宇宙的总熵会不断增大,虽然能量的总量不会变,但是可以被利用的热量终究会耗尽,最后整个宇宙都会变成充斥着无用热量且温度一致的死寂状态,人们给它起了一个很形象的名字:热寂。
如果套用卡诺热机的说法,就是宇宙中的高温热源最终会与低温热源趋于相同的温度,变成单一热源,那么就再也不可能造出能做功的卡诺热机了。人们也就再也没办法利用能量,只能守着这一团热粥孤独死去了,是不是很绝望?
人们不愿意相信这个令人窒息的未来,于是在热寂理论提出之后,人们便开始寻找它的瑕疵,人们努力的方向主要有两个:
一个方向是从热力学本身来看,它是一套惟象理论,即是从实验出发,归纳总结出的规律,它本身并不能给出“为什么”的答案,也就是说人们知道熵的特性,但是却不能解释为什么熵具有这个特性。因此人们寄希望于能有一个揭示熵的本质的理论,若这个理论中熵特性与热力学第二定律不同呢,那说明热寂就有被推翻的可能了,如果不幸与热二律符合,那至少能死个明白,朝闻道,夕死可矣,对吧。
另一个方向,就是在接纳热力学第二定律的前提下,去找证据证明我们的宇宙并不是一个孤立系统,如果不是,宇宙总熵也就不会一直增加,也就不至于进入热寂状态了。在这条路上,人们可谓是开尽了脑洞,比如宇宙膨胀理论,宇宙总体积在扩大,让熵增赶不上宇宙扩张引起的熵减少;再比如平行宇宙理论等,但我总觉得这些解释都有点病急乱投医的意思,提出的理论比热寂还要让人吃惊,而且尚缺实验检验,好在这并不是本文的重点,在这就先带过了。
下文咱就从第一个方向上,看看人们是如何逐渐深刻的认识熵的吧。
破局者:玻尔兹曼在本质层面上对热力学进行研究的,就是玻尔兹曼!在视频中我讲到了,玻尔兹曼是一位坚定的原子论者,他致力于从原子运动的角度去描述热现象。
最初他是受到了麦克斯韦关于平衡态气体中分子速率分布论文的启发,说到这不得不再次膜拜麦克斯韦这位全能的天才,玻尔兹曼曾经表达过他对麦克斯韦这篇论文的赞叹,说它像乐章一样的美妙,因此有理由认为,在玻尔兹曼开辟统计物理学新领域的过程中,麦克斯韦对他有着重要的影响!
玻尔兹曼认为,宏观上我们看到的热现象,只不过是大量的微观原子(分子)运动的表现。如果掌握了这些原子的运动规律,那么由这些原子组成的宏观物质的热学特性也就搞清楚了。但问题的关键是,摆在我们面前的是多少原子?
是以摩尔为单位计的原子系统啊,1mol = 6.02 x 10^23个。即便不考虑转动,描述一个原子需要3个自由度,那描述1mol原子的运动,那就需要 3 x 6.02 x 10^23 个自由度啊,这可要命了…… 常规方法肯定是不行,因此玻尔兹曼采用了统计学的方法,转而去研究大量原子的统计分布特性,这就是他所创立的统计物理学!
当然,玻尔兹曼所处的年代,微观世界是什么样子,人们还没搞清楚,量子力学更是遥遥无期。因此,玻尔兹曼的理论对原子的假设很简单,就是一些硬质小球,彼此之间是可以区分的,而且它们之间除了碰撞之外并没有其它作用力,即彼此独立。
之所以强调这些假设,是告诉大家玻尔兹曼处理的是经典的独立粒子系统,是有局限性的,在量子力学出现后,针对具有不同自旋状态、且彼此不可区分的全同粒子系统,后人又结合量子力学和统计物理,得到了不同于玻尔兹曼分布规律的其它两个分布律,即玻色-爱因斯坦分布和费米-狄拉克分布,这两个分布在经典近似下,都可以退化为麦克斯韦-玻尔兹曼分布!
熵的微观定义,是玻尔兹曼统计物理学的一大成就,为人们认识熵打开了一扇全新的大门!他得出的关于熵的方程,就是铭刻在他墓碑上的那个著名公式!

下面借用一个例子说明玻尔兹曼的熵。我们都有这样的常识,如果把一个密闭容器的中间放置一个密封隔板,然后在左侧充入气体,右侧抽真空,那当你突然抽出隔板的时候,气体就会迅速充满整个容器,而不是继续挤在左侧,这是常识,但你考虑过为什么吗?

经典热力学告诉我们,这是一个不可逆的自由膨胀过程,在这个过程中,气体的熵是增加的,同时温度会降低。但热力学定律虽能帮你计算熵增的大小,也能告诉你这些扩散开来的气体不会再自发的回到容器的左半边,但是,它却无法告诉你为什么!它更像一个上帝设定的禁忌规则一样,规则就摆在那,它禁止那些事情发生!至于为什么要设定这个规则,对不起,他老人家并不打算向你透露一丝线索!
想要揭开这个谜团,靠宏观的热力学是不可能的,我们必须把目光放到微观层面,看每一个气体分子在这个过程中,行为有什么特点。为了讨论简便,我们看一个简化的模型,假设这个容器,里面只装有6个气体分子,如果把容器分为左右两侧,显然对每一个分子而言,要么在左边,要么在右边,那么这6个分子共有几种分布方式呢?
显然,共有7种分布方式,列在下图中,对于某些分布方式,实现方式还不止一种。下图中列出了这七种可能的分布,以及每一种分布的实现方式数。举例说,让这6个分子5左1右的分布,有几种方式?其实就相当于让我们从这6个分子中选5个出来放在左边,问我们有几种选法嘛,所以显然是6种咯。

通过穷举它们,不难发现,左三右三这种平均的分布,实现方式最多,而且两边的分子数越趋近于一致的分布,实现的方式越多!所有的实现方式加起来共有64种,其中左右相等的分布方式就占了近1/3。在统计物理中,这里所说的每一种“实现方式”,对应一个“微观状态”,因为它描述了微观粒子的不同组合方式。
接下来,我们假设这每一种的实现方式都是等概率出现的(微观态的等概率假设),也就是说,如果随机观察1次小球位置分布的话,只会有 1/64 的概率恰好观察到所有分子都聚集在左侧!但相比来说,有1/3的概率观察到左右两边各有三个分子!
但是提醒大家,刚刚计算的仅是有6个分子的情况,如果容器中的分子数多达100个的时候,仅是左右各50个分子的分布就有 10^29 种实现方式,而所有分子聚集在左侧的分布方式还是只有一种!所以你能观察到100个分子恰好都位于左侧的概率,仅仅是 (1/2)^100 ,约等于 1 / (7.88 * 10^31)! 这个概率到底多小,假设你观察一次容器中的分子分布需耗时1秒,那么想要观察到这种情况需要耗费的时间,大约是宇宙年龄的170多倍(宇宙年龄按照150亿年计)!
但是别忘了,这才是区区100个分子,我们宏观气体的分子数,都是以摩尔为单位来计算的!对于1摩尔的气体分子,刚才这个概率就变成了(1/2)的60万亿亿次方。这个数是多少我不知道,MATLAB无法计算如此庞大的数字,反正在实际中是绝无可能观察到这种分子都挤在左半边的情况的。
上面所做的这些分析就是玻尔兹曼的统计物理学思想所告诉你的道理,所谓上帝的禁忌规则,不过是由相差悬殊的概率分布导致的!所有气体分子都挤在左侧并非被禁止出现,只是它发生的概率太太……(此处省略无数个“太”)太小了,在日常生活中你根本不可能观察到。所以,在现实中,当我们抽掉隔板后,这巨量的气体分子迅速趋于了概率最大的那种分布方式,即左右两侧粒子数基本相等。
玻尔兹曼眼中的“熵”好了,咱们再来梳理一下上面分析中的一些关键知识点:
- 气体分子都集中在左侧 --> 微观状态数少 --> 出现概率小 --> 混乱度低(有序度高)--> 熵值低
- 气体分子左右平均分布 --> 微观状态数多 --> 出现概率大 --> 混乱度高(有序度低)--> 熵值高
你看,站在微观的视角看,熵,表征的是系统微观状态数的多少(刚才的例子中,就是分子不同分布方式有多少种实现方法),微观状态数越多,系统越混乱,熵就越高,反之熵就越低。因此,也就很容易明白,在实际中我们抽掉隔板,系统就会迅速趋向于微观状态数最多的那种分布方式(左右分子数相等),在这个过程中,系统的熵是增加的。
因此,玻尔兹曼认为一个系统的熵,应该与系统中原子(分子)的微观状态数W的对数成正比!即:

玻尔兹曼的熵公式,首次建立了微观与宏观之间的联系,用系统微观状态的数目来表达宏观的熵,而微观状态数的多少,又是系统混乱程度的量度。它向我们深刻揭示了熵的本质!我个人认为,从这个公式对后人认识世界的影响来看,玻尔兹曼的贡献怎么吹都不为过。
扩展阅读1:刚才的自由扩散问题极度简化并抽象了问题实质,其实实际分子的微观状态要更加复杂,因为我们刚刚只考虑了气体分子的位置分布数,气体分子还具有不同的速度,而速度分布依赖于系统温度,一个气体系统总的微观状态数,应该是位置分布状态数和速度分布状态数的乘积,这些就是统计物理学要精确求解的问题了。所以玻尔兹曼的数学功底还是相当强大的!
扩展阅读2:玻尔兹曼最初的熵公式就是上面的样子,而墓碑上的公式多了一个常数k,这是由他的追随者,也是量子力学的开山第一人,普朗克先生为他添上去的,并且命名为玻尔兹曼常数,它是联系宏观和微观的一座桥,用来衡量分子热运动的强度,其重要性堪比量子力学中的普朗克常数h。
悲情英雄的落幕玻尔兹曼是伟大的,但又是悲惨的。相比于所处的时代,他走的有点太超前了,因为那个时代,原子是否存在,并不是一件显而易见的事情,同时代还有一个“唯能论”学派势头正劲,而他们与玻尔兹曼展开了旷日持久的论战,这场论战从科学打到哲学,让孤军奋战的原子论斗士玻尔兹曼感到身心俱疲。终于在1906年,不堪重负的他,在携家眷到意大利度假的过程中,在一个小旅馆中,用窗帘结束了自己伟大的生命,不得不让人顿首。
更加让人感到惋惜的是,他哲学思想上的老对头,化学家奥斯特瓦尔德,在他自杀的两年后,在一篇论文中声称,他接纳原子论,玻尔兹曼是对的。而在接下来的十几年,是原子论与量子力学全面胜利的时代,但是玻尔兹曼,却看不到这些了……
待续实在太长了,后面还有很多要说,本篇就算开个头吧。因为看到字数已经破5k了,再写下去有没有人看并不重要,重要的是系统会不会说我字数太多,直接发不出去了。
下一篇将接着本篇的思路,继续探讨在玻尔兹曼开辟的这条路上,人们对有序和无序,对世界和生命所做的那些有趣且深刻的思考。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






