使用氨的燃料电池(氨燃料电池NatureChemistry二钌络合物实现高效氨电催化氧化)
喜欢就关注我们吧,订阅更多最新消息


第一作者:Michael J. Trenerry,Christian M. Wallen.
通讯作者:John F. Berry
通讯单位:威斯康星大学麦迪逊分校
论文DOI:https://doi.org/10.1038/s41557-021-00797-w
全文速览
直接氨燃料电池(DAFC)中,将氨电化学转化为氮气是实现氮循环的重要技术。以前主要用分子复合物催化这种反应,并且需要添加外源性氧化剂或应用比氧还原反应(DAFC的阴极过程)热力学电位更高的电位。作者在此报告了一种稳定的金属-金属键合的二钌配合物,它可以在室温条件下从氨中自发产生氮气。得到的还原二钌材料可以用氧气再氧化,用于随后与氨的反应,证明其能够自发地促进DAFC所需的两个半反应。二钌配合物还充当氧化还原介质,用于在-255 mV vs. Fc0/ 的电位下将氨电催化氧化为N2,并在碱性条件下,在氧还原反应电位以下运行,从而实现热力学可行的DAFC的发展。
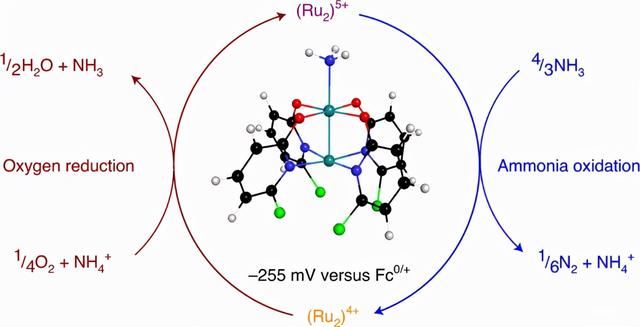
背景介绍
零碳燃料技术的发展对社会具有重要意义,解决这个问题的主流框架是“氢经济”。但由于一些实际限制(例如,生产、储存、安全性),学术界提出了替代的零碳燃料经济。其中最引人注目的是“氮经济”,重点是使用氨作为燃料。由于工业已经实现通过Haber-Bosch工艺大规模生产氨,因此,专门用于大规模分配和储存氨的基础设施已经非常完善。此外,在安全性和效率方面,氨在温和压力下较低的爆炸危险和优越的可压缩性,使得其比氢气更具有优势。此外,工业界可以通过两项关键技术的持续发展来建立功能性氮/氨经济:由可再生能源驱动的氮和水合成“绿色”氨,以及氨的高效氧化为燃料电池提供动力。
开发直接氨燃料电池(DAFC)的主要挑战在于确定氨氧化反应(AOR)的电催化剂。此外,实用的燃料电池需要将阳极的AOR与阴极的氧还原反应(ORR)耦合。对于在DAFC中可行的AOR催化剂,必须满足两个要求:对于热力学可行性,催化剂的操作电位必须低于热力学ORR电位,而动力学可行性涉及到以有用的反应率克服电阻损失。最近在无机化学领域的大量研究,发现了几种新的AOR催化剂。然而,在报告电催化的已知系统中,电催化AOR的操作电位要么超过ORR规定的上限,要么仅以很小的幅度低于它(<50 mV)。这些系统的缺点可能部分归因于催化AOR的机制。具体而言,已知的单金属钌催化剂会导致高度氧化的亚氨基和氮化中间体,这需要高操作电位。
图文解析

图1.氮/氨燃料概述和DAFC的催化进展。a,氮/氨经济的基本组成部分。右图:从空气和水中电化学合成氨。左:DAFC。b,基于钌的分子AOR催化剂的操作电位以红色显示,本工作的Ru2(chp)4NH3 的操作电位以蓝色显示。
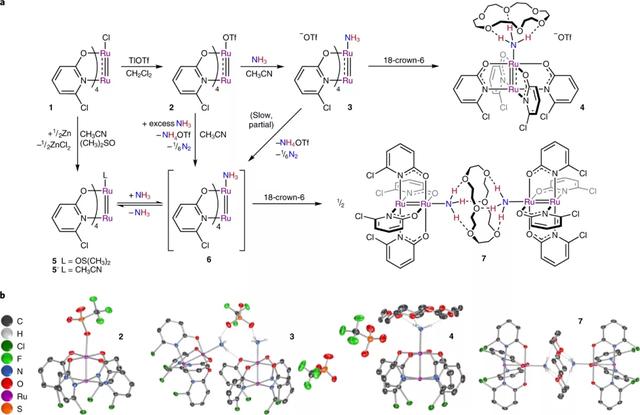
图2.关键的Ru2化合物的合成和结构表征。a,二钌化合物的合成和反应性,包含了7种复合物。b,复合物2、3、4和7的晶体结构。为简单起见,省略了所有与碳结合的氢原子。

图3.氨氧化催化的电化学和光谱研究。a,使用玻璃碳圆盘电极和100 mM Bu4NPF6电解质,在CH3CN中以100 mV s-1收集的循环伏安曲线图。从上到下是:复合物2与复合物5' 平衡的循环伏安图(红色曲线),复合物3由3.2摩尔当量的NH3添加到复合物2(紫色曲线)形成,复合物6由添加10摩尔当量的NH3到复合物5(橙色迹线)形成。b,在CH3CN中控制电流(0.5 mA),用<5 mM(红色迹线)或235 mM NH3(蓝色迹线)电化学氧化复合物5 (0.22 mM) 的曲线。此外,作者还显示了对照实验:不含[Ru2]的235 mM NH3(绿色曲线)溶液,以及不含NH3和[Ru2]的溶液(粉红色曲线)。c,在CH3CN中,使用<5 mM(红色迹线)或235 mM NH3(蓝色迹线)对5号复合物进行受控电流批量电解期间,530 nm 处的吸光度。d-f,电子吸收光谱监测2号复合物 与 100当量NH3的还原(d),随后与氧气的再氧化(e),和与额外的100当量NH3的再还原(f)。扫描之间的时间间隔为5分钟。

图4.法拉第效率实验中使用的设备和收集的数据。a,法拉第效率实验中使用的大容量电解池。b,循环电解含有Ru2物质、Bu4NPF6电解质和15NH3(蓝色迹线)的溶液,以及仅含有Bu4NPF6电解质和15NH3的溶液(红色迹线)得到的电流曲线(顶部)和m/z = 30 质谱曲线(底部)。c,左轴:Ru2物质与15NH3反应产生的15N15N的理论产率(黑色)和实验产率(蓝色)。右轴:在含有Ru2物质、Bu4NPF6电解质和15NH3(蓝色曲线)的溶液以及仅含有Bu4NPF6电解质和15NH3(红色曲线)的溶液的循环电解过程中通过的电荷。

图5. Ru2复合物电子结构特征和氨反应机理。a,DFT计算显示了复合物8中的Ru-Ru-NH2 π* LUMO。b,c,DFT计算的几何形状(b)和过渡态TS 1 的表示(c),显示通过NH3对复合物8的亲核攻击形成N-N键。d,所提出的氨电化学氧化催化循环。
总结与展望
基于上述结果,作者发现金属-金属键合的二钌配合物能够在低过电位下对氨进行电催化氧化,在ORR的热力学电位之下运行。此外,作者提供了证据,表明二钌AOR催化剂可以通过与分子氧反应再生,这一发现在其他报道的分子AOR催化剂中是没有的。作者的机理研究表明,金属-金属多重键能够形成N-N键,而无需获得单钌系统AOR所需的高能Ru=NH亚胺或Ru ≡ N 氮化物。这一特征是使[Ru2]4 物质与分子氧轻松再氧化的关键,为探索具有更低[Ru2]4 /5 电位的新催化剂,作为直接氨燃料电池中的可能成分打开了新的大门,在实现氮经济方面取得了令人振奋的进展。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






