化学反应与能量变化计算(化学反应与能量变化)
第1课时 化学键与热能的相互转化
学习目标
1.通过分组实验,学会观察、记录实验现象,以及从分析现象中得出结论。
2.掌握化学能与热能的相互转化的实验依据。
3.巩固吸热反应、放热反应的概念,了解中和热的测定方法。
1.请说出决定一个化学反应是放热还是吸热的因素是什么(要求从两个方面进行说明)。
2.2Al 6HCl
2AlCl3 3H2↑反应 热;
Ba(OH)2·8H2O 2NH4Cl
BaCl2 2NH3↑ 10H2O反应 热;
H OH-
H2O反应 热。
3.写出实验6-1所涉及的离子反应方程式: 。
写出实验6-2所涉及的化学反应方程式: 。
写出测定中和热所涉及的离子反应方程式: 。
4.阅读课本P32,完成[思考与交流]。
5.常见的放热反应有: ;
吸热反应: 。一、化学反应中能量的转化
1.【实验探究】铝与盐酸的反应

(1)铝与盐酸反应的化学方程式: 。
(2)在反应过程中你将能看到什么现象?
(3)用眼睛不能直接观察到反应中的热量变化,你将采取哪些简单易行的办法来了解反应中的热量变化?
(4)要明显地感知或测量反应中的热量变化,你在实验中应注意哪些问题?
2.【实验探究】Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
【注意】由于这个实验成功的关键是在短时间内反应充分进行,使体系温度快速降低,将玻璃片上的水凝固。实验中要注意三点:(1)将Ba(OH)2·8H2O晶体研磨成粉末,以便与NH4Cl晶体充分接触;(2)由于该反应属于固相反应,一定要在晶体混合后立即用玻璃棒快速搅拌混合物,以使它们很快起反应;(3)反应放出有刺激性气味的氨气,会造成学习环境的污染,所以要注意对氨气的吸收。
【分组实验】阅读教材并根据已有知识设计实验步骤如下:
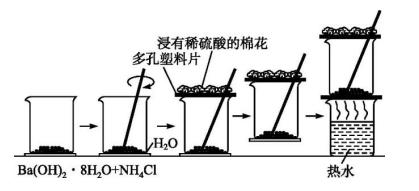
【填写实验记录】
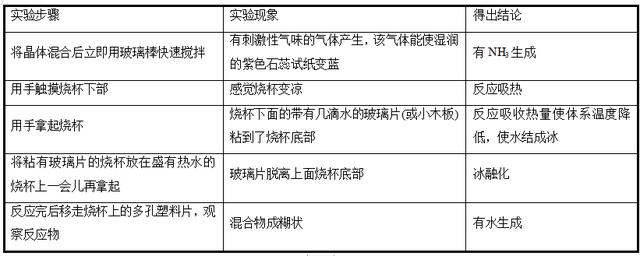
用化学方程式表示上述反应: 。
二、中和热的测定
1.中和热的概念
在稀溶液中,酸与碱反应生成 所释放的热量。
2.中和热的测定
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
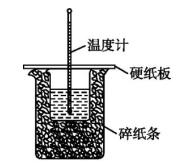
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由 。
3.思考与总结
要想提高中和热测定的准确性,实验应注意什么?
4.【学生分组实验】三个学生分成一组进行实验,其中每个学生做一个实验并记录现象和数据,供组内交流、比较使用,然后讨论得出结论。最后向全班汇报,进行组间交流。
【填写实验记录】

【讨论分析】三个反应的化学方程式和离子方程式分别为:
;
;
。
三、化学能与热能的相互转化
【交流研讨】
1.化学反应遵循 定律和 定律。
质量守恒: 。
能量守恒: 。
2.物质发生化学反应的同时还伴随着 的变化。化学能是能量的一种形式,可以转化为其他形式的能量如 和 等。而这种变化通常主要表现为 的变化,即 或 。如果二者能量比较接近,则放热和吸热不明显。
未完,有需要的朋友,私信免费送哦
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






