柠檬酸镍的溶度积常数(JBiosciBioeng)
今天推送的文章是发表在Journal of Bioscience and Bioengineering上的“Role of C-terminal domain in a manganese-catalase from Geobacillus thermopakistaniensis”,通讯作者是来自旁遮普大学生物科学学院的Naeem Rashid。
过氧化氢酶 (EC1.11.1.6) 催化过氧化氢分子分解为水和氧气,是工业上重要的酶,可应用于造纸、纺织、医疗和食品工业。根据序列和结构,过氧化氢酶主要分为三种类型。其中两种由血红素过氧化氢酶组成,包括单功能过氧化氢酶或双功能过氧化氢酶过氧化物酶,而第三组包括在其活性位点含有锰而非血红素的非血红素锰过氧化氢酶。血红素过氧化氢酶是最普遍和充分表征的,而锰过氧化氢酶尚未得到广泛研究。已在细菌和古细菌中发现锰过氧化氢酶,但在真核生物中未发现。它们在功能上与血红素过氧化氢酶相似,但在结构上却截然不同。大多数锰过氧化氢酶是同六聚体和少数同四聚体。三种可用的晶体结构表明锰过氧化氢酶具有三个不同的结构域,一个N端结构域、一个中心结构域和一个C端结构域。中心结构域包含一个四螺旋束,这是所有锰过氧化氢酶的标志性结构基序,包含双核锰复合物和催化核心。与血红素过氧化氢酶相比,这种四螺旋束结构赋予锰过氧化氢酶额外的结构稳定性。
在作者之前的研究中,报告了在大肠杆菌中异源产生两种锰过氧化氢酶CatGt和Cat-IIGt,它们来自嗜热、好氧和革兰氏阳性细菌Geobacillusthermopakistaniensis。表征研究表明,尽管CatGt和Cat-IIGt都是来自同一生物体的锰过氧化氢酶,但它们的结构和性质表现出显著差异。CatGt是两种蛋白质中较大的一种,与Cat-IIGt相比,活性较低且热稳定性更高。两种蛋白质之间值得注意的结构差异是CatGt中的扩展C末端。考虑到两种酶的特性差异,有必要探讨C末端结构域的作用。该研究描述了CatGt的C末端结构域的缺失及其对截短酶特性的影响。
CatGt-ΔC的设计。CatGt的C末端截短产生CatGt-ΔC,一种具有214个氨基酸残基的多肽,理论分子量为23,925 Da。截断区域主要包含无规卷曲以及极少数的β-折叠或α-螺旋。其设计考虑了Cat-IIGt和基于T. thermopHilus锰过氧化氢酶的结构的域边界。CatGt-ΔC中包含C端结构域的几个氨基酸,因为Cat-IIGt包含以VF结尾的C端结构域的八个氨基酸。因此,在CatGt-ΔC中做出了类似的结尾(图1)。

图1
CatGt和CatGt-ΔC的分子模型。CatGt的三维同源模型预测2 Mn2 与酶的每个单体结合(图2A)。该结构主要由α-螺旋和C-和N-末端延伸的无序尾组成。Ramachandran图显示96.3% (286/297) 的氨基酸残基位于偏好区域。仅发现一个异常值(Gly88),99.7%(296/297)残基存在于允许区域。与CatGt相似,预测的CatGt-ΔC三维同源模型也显示2个Mn2 与四螺旋束核心内的每个单体结合(图2B)。这表明缺少 C 端可能不会影响金属结合。Ramachandran 图显示98.1% (208/212)的残基位于有利区域。另一种过氧化氢酶Cat-IIGt已从 G. thermopakistaniensis中表征。尽管这种酶与全长CatGt仅具有23%的序列同一性,但它们的结构在核心结构区域非常相似(图2C)。这两种结构叠加的RMSD为 1.29 Å。尽管四螺旋束在两种结构中都很好地对齐,但两种蛋白质之间值得注意的结构差异是CatGt中的扩展C末端,而Cat-IIGt中不存在。当将CatGt-ΔC与Cat-IIGt进行比较时,RMSD为1.26 Å (图 2D)。CatGt的C末端结构域的截断使氢键和盐桥的数量分别从22和26个减少到CatGt-ΔC中的15个和5个。
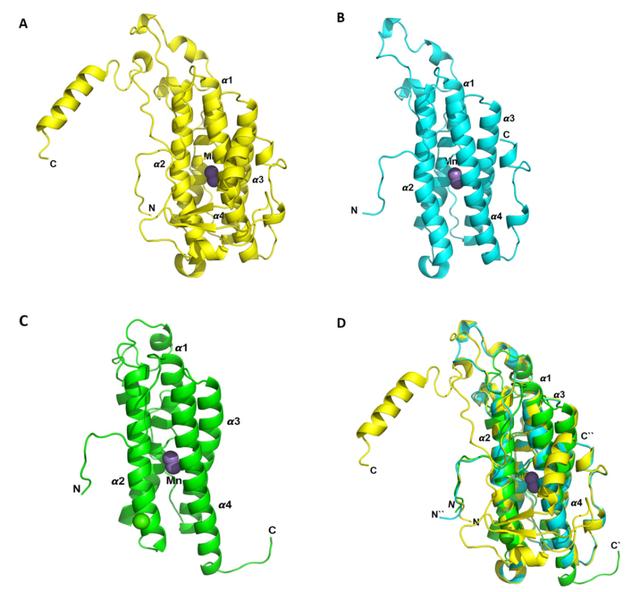
图2
CatGt和CatGt-ΔC中的金属结合位点。在CatGt-ΔC中与CatGt相同的位点发现了两个Mn2 ,因为保守的锰结合残基存在于包含四螺旋束的中央结构域中,因此不受 C 端截断的影响(图1和3)。发现两个 Mn2 参与与三个谷氨酸残基Glu37 、GluGlu71 、GluGlu151;两个组氨酸残基,His74 和 His His184;和Thr40 、TyrTyr44 、LysLys158和Leu177的配位(图3)。发现这两个Glu和His残基在先前已表征的所有锰过氧化氢酶中都是保守的。在CatGt-ΔC中,没有发现与CatGt相似的Ca2 配位位点。这使得这些蛋白质不同于来自同一生物体的其他锰过氧化氢酶Cat-IIGt,据报道,Ca2 的作用是稳定同源六聚体复合物。金属含量分析也验证了CatGt-ΔC的每个亚基有~2 Mn2 ,而没有检测到Ca2 。

图3
CatGt和CatGt-ΔC中的底物结合位点。分子对接结果显示过氧化氢与 CatGt 相互作用在三个不同的结合位点。有人提出,过氧化氢在三个位点中的两个位点的结合似乎是变构的,具有最小可能的结合能。这些位点存在于蛋白质表面,与这些位点结合的过氧化氢可能会诱导一些构象变化,从而允许底物进入酶活性位点。由于CatGt的长柔韧 C 末端尾部在四螺旋束上组织松散,因此假设尾部可能会阻止过氧化氢直接进入位于四螺旋束核心内的酶活性位点。过氧化氢以较低的亲和力和较高的解离常数与酶活性位点结合。在这里,过氧化氢的结合也通过其与酶活性位点峡谷中存在的Mn2 的相互作用而稳定。过氧化氢与Glu37 、GluGlu71 、HisHis74 、GluGlu151和 His184形成氢键,而 Thr40 、LysLys158、Arg180和 Gly181通过疏水相互作用稳定结合(图4A)。过氧化氢还与酶活性位点中的Mn2 形成共价键和氢键。这种酶中的Lys158似乎是T. thermophilus中锰过氧化氢酶中催化残基Lys162的替代品。在酶的周转过程中,这种 Lys被提议用于将过氧化质子转移和偶联到活性位点残基和锰氧化还原中心。在CatGt-ΔC模型中,与CatGt相比,过氧化氢以相对较高的亲和力、更高的特异性和更低的解离常数结合。过氧化氢的结合能为约3.63 kcal/mol,而解离常数为 5.08 mM。过氧化氢的结合通过其与酶活性位点峡谷中存在的Mn2 的相互作用而得以稳定(图4B)。与CatGt相比,CatGt-ΔC中的非特异性底物结合需要相当高的解离常数和结合能。

图4
重组CatGt-ΔC的生产。CatGt-ΔC基因在大肠杆菌中的表达导致重组蛋白 (~24 kDa) 的产生,主要是不溶性和无活性形式。表达条件的变化,包括培养温度、IPTG 的诱导浓度和生长培养基中 Mn2 的补充,在重组CatGt-ΔC的可溶性生产中仍然不成功。此外,在诱导之前通过冷或热休克激活宿主伴侣蛋白是不成功的。最后,在体外用尿素溶解CatGt-ΔC包涵体,随后在2 mM Mn2 存在下通过分级透析进行再折叠,成功地获得了可溶性和活性重组蛋白。在重新折叠过程中,Mn2 的补充促进了酶的正确折叠和apo形式向holo形式的转化。这种方法导致以可溶和活性形式回收近25% 的最初使用的不溶性蛋白质。从1L细菌培养物中获得近45 mg可溶性重组CatGt-ΔC,从~2850 mg细胞(湿重)产生~180 mg包涵体。当通过凝胶过滤色谱法测定CatGt和CatGt-ΔC的分子量时,发现CatGt在溶液中以四聚体形式存在,CatGt-ΔC在溶液中以单体形式存在。

表1
pH、温度和金属离子对过氧化氢酶活性的影响。CatGt-ΔC的最适pH值与CatGt相似,在pH 7.0~7.5 的磷酸钠缓冲液(图7A)中发现最高活性。同样,重组CatGt的最适温度为60℃没有变化。当比较CatGt和CatGt-ΔC在80和100 ℃时的热稳定性时。CatGt-ΔC的半衰期为80 ℃ 4.5小时和100 ℃ 20分钟(图7C),而 CatGt的半衰期为 80 ℃ 8 小时和 100 ℃ 1小时(表1)。这些结果表明,可能由于相关的结构变化,C-末端截短降低了蛋白质的热稳定性。在与1 mM EDTA孵育或将其添加到测定混合物中后,观察到CatGt-ΔC的过氧化氢酶活性显著降低。当在各种金属离子(100 mM)存在下进行活性测定时,在Mn2 存在下活性增加了两倍以上(图 8A)。当在不同浓度的Mn2 存在下检查重组CatGt-ΔC的过氧化氢酶活性时,与不含额外金属离子的对照样品相比,2 mM Mn2 的活性增加了十倍以上(图 8B)。CatGt-ΔC的底物特异性和催化活性与CatGt没有显著差异。CatGt和CatGt-ΔC的动力学参数比较见表1。从数据可以看出,CatGt-ΔC表现出比CatGt更低的Km值和更高的催化效率。

图7

图8
综上,删除C末端结构域会消除非特异性结合,从而提高底物亲和力。CatGt和CatGt-ΔC的最适pH、最适温度和底物特异性无显著差异。然而,Km值从259降低到157 mM,与CatGt相比,CatGt-ΔC的催化效率提高了1.5倍。此外,去除C末端结构域将四聚体性质转化为单体,并降低了截短蛋白质的热稳定性。这些结果表明,CatGt的C末端结构域可能在维持酶功能方面几乎没有作用,但为蛋白质提供了额外的结构稳定性,这是工业应用所需的特性。
1 -END-
文章信息:
PMID: 35811183
DOI: 10.1016/j.jbiosc.2022.06.010
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






