高三化学一轮表格题(高考化学第一轮复习专题)
考点一 物质的量与阿伏加德罗常数
9.(2014大纲全国,7,6分)NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
答案 D 1 mol FeI2与足量氯气反应时转移的电子数为3NA,A错误;1个S带2个单位负电荷,此溶液中S所带电荷数为2NA,另外,该溶液中还有OH-,阴离子所带电荷数大于NA,B错误;1 mol Na2O2固体中含离子总数为3NA,C错误;丙烯和环丙烷的分子式均为C3H6,则42 g即1 mol混合气体中含氢原子个数为6NA,D正确。
10.(2013大纲全国,8,6分)下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
答案 C 依据阿伏加德罗定律可知,在同温同压下的两种气体体积相同,分子数相同,而每个12C18O和14N2分子所含电子数相同,C项正确;同温同压同体积条件下密度之比等于摩尔质量之比,12C18O的摩尔质量为30 g·mol-1,14N2的摩尔质量为28 g·mol-1,A项错误;1个12C18O分子中所含中子数为16,1个14N2分子中所含中子数为14,B项错误;n=,m相同、M不同,n不同,D项错误。
4Ag O2↑,
2Fe(OH)3===Fe2O3 3H2O↑,2NH4HCO3===2NH3↑ 2CO2↑ 2H2O↑,
2NaHCO3=== Na2CO3 CO2↑ H2O↑,由上面的分解反应可知,V3>V2>V4>V1,A项正确。
14.(2012江苏单科,8,2分)设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
答案 B A项,Cl2 H2O

HCl HClO,0.1 mol Cl2没有完全反应,转移的电子数目少于0.1NA;B项,n(H2O)==1 mol,原子总数为3NA;C项,标准状况下,CH3CH2OH为液体,不能根据气体摩尔体积计算其物质的量;D项,常温常压下,2.24 L CO和CO2混合气体的物质的量小于0.1 mol,所含碳原子数目少于0.1NA。
15.(2012上海单科,11,3分)工业上将氨气和空气的混合气体通过铂-铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A. B. C. D.
答案 D 根据反应4NH3 5O2
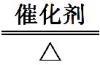
4NO 6H2O,当有标准状况下V L NH3完全反应时,NH3的物质的量为 mol,转移电子的物质的量为 mol,已知在此反应中转移电子数为n,则n=×NA,所以,NA=,故选D。
考点二 物质的量浓度及相关计算
6.(2011课标,7,6分)下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na 的最外层电子总数为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
答案 B NaCl是离子化合物,是由Na 和Cl-结合而成的,不存在NaCl分子,A错;1.00 mol NaCl中含有1.00 mol Na ,Na 的最外层电子数为8,故1.00 mol NaCl中所有Na 的最外层电子总数为8×6.02×1023,B正确;NaCl溶液的体积为1.00 L,而不是水的体积为1.00 L,C错;n(NaCl)=1 mol,电解后得0.5 mol Cl2,标准状况下的体积为11.2 L,D错。
评析 本题主要考查物质的组成、物质的量浓度的含义及有关气体体积的计算等知识,较易。
7.(2011上海单科,17,3分)120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol/L B.1.5 mol/L
C.0.18 mol/L D.0.24 mol/L
答案 B 前者滴入后者发生反应:Na2CO3 2HCl

2NaCl H2O CO2↑①,后者滴入前者发生反应:Na2CO3 HCl===NaCl NaHCO3②,NaHCO3 HCl=== NaCl H2O CO2↑③,盐酸的用量应在①②之间,即HCl的物质的量应为0.20 mol<n(HCl)<0.40 mol,即1 mol/L<c(HCl)<2 mol/L,故选B。
8.(2011广东理综,9,4分)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,23 g NO2含有nA个氧原子
B.1 L 0.1 mol·L-1氨水含有0.1nA个OH-
C.常温常压下,22.4 L CCl4含有nA个CCl4分子
D.1 mol Fe2 与足量的H2O2溶液反应,转移2nA个电子
答案 A n(NO2)==0.5 mol,n(O)=1 mol,A项正确;NH3·H2O是弱电解质,不能完全电离,故OH-的物质的量小于0.1 mol,数目小于0.1nA,B项错误;常温常压下,CCl4为液体,不能根据标准状况下气体摩尔体积计算其物质的量,C项错误;Fe2

Fe3 ,1 mol Fe2 与足量的H2O2溶液反应,转移nA个电子,D项错误。
评析 本题主要考查阿伏加德罗常数的有关计算,较容易。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






