肝功能异常的健康指导(基础知识酸碱异常与肝功能障碍)
七彩祥云翻译组出品
编译:武彧、王强、王碧成、杨德兴、徐冕、周凤高、许成、赵琨
审核:刘荣
单位:昆明医科大学第一附属医院ICU

摘 要
除了肾脏和肺部,肝脏在调节酸碱平衡(ABE)中也起着重要作用。肝脏参与ABE的调节是至关重要的,因为它在乳酸代谢、尿素生成和蛋白质稳态中发挥作用。肝硬化患者发生的主要酸碱失衡是呼吸性碱中毒(RAlk)。由于这些患者存在影响ABE的其他病理生理机制,因此可能会出现其他疾病来代偿或加重原发性疾病。传统的ABE评估模式无法识别和评估肝硬化患者的潜在疾病。它的不足促进了新的理化数学模型的建立,该模型考虑了所有出现和影响ABE的已知参数。除了RAlk,在肝硬化患者中,代谢性碱中毒(由于低蛋白血症)、低钠性代谢性酸中毒、高氯性代谢性酸中毒、乳酸酸中毒和尿素代谢引起的代谢性碱中毒也是影响ABE的一些病理生理机制。
关键词:酸碱平衡/肝病/肝硬化
引言
酸碱平衡(ABE)是机体的一个重要指标,其平衡是由细胞每天的新陈代谢(内源性)以及食物的摄入(外源性)决定。机体内的酸由氢离子(H )表示,而碱则由碳酸氢根(HCO3-)表示。
肾脏和肺是调节机体ABE的主要器官。然而,近年来,人们越来越认识到肝脏也参与ABE的调节,且不同于肾脏和肺。探索肝脏在酸碱平衡中的作用,对于混合性ABE疾病有着重要的意义。为了了解肝病患者的ABE紊乱,下面将对ABE理论进一步阐述。
众所周知,血清中H 及碱基的浓度通过pH表示,pH值7.4为正常值,酸中毒时pH值<7.36,碱中毒时pH值>7.44。
1.1 ABE法则
为了描述血液中ABE,基于简单溶液(水)和混合溶液(如血液)的理化性质的数学模型经常被引用,在以下这些模型中,将简要介绍三种主要模型。
A. 传统的ABE固定模型是由Henderson- Hasselbalch根据酸分解的化学反应提出的
HA ↔[A-] [H ]
考虑质量作用定律(分解常数K),用方程表示某一时刻酸碱平衡态:
pH=pK log[A-]/[HA]
在上述模型中,H2CO3被用作酸,分解后得到[H ]和自由基[HCO3-],则前面的方程为:
pH=pK log[HCO3-]/[H2HCO3]
但在上式中,由于血浆中H2CO3浓度较小(37℃时,血液中每mmHgPaCO2会溶解为0.03mEq/L CO2),因此溶解CO2的血浆为酸性。因此,ABE的Henderson-Hassel- balch数学模型的最终方程为:
pH=pK log[HCO3-]/[0.03xPaCO2]
在正常情况下,PaCO2是40mmHg,[HCO3-]为24mEq/ L,pKH2CO3=6.1,pH=7.4。
B. ABE的第二个理化模型是由Stewart(1983)提出的,它是基于血液属于含CO2的溶液(其他三种是:蒸馏水、强离子、弱碱)的观点。因此,为了计算某一特定时刻血液中[H ]的浓度及pH值,建立了强离子差模型(SID)。这个术语表示所有强阳离子和所有强阴离子之间的区别。然而,因为强阴离子优于强阳离子,所以SID是负的,而SID被认为是代表净不平衡正电荷的一个指标。根据上述模型,SID由下式计算:
SID=[Na ] [K ] [Mg2 ] [Ca ]-[Cl-]-Lactate
由上式计算的SID没有考虑弱酸如白蛋白、磷和二氧化碳在电荷平衡中的作用,因此最佳指标为表观SID(SIDa),弱酸的作用是通过以下Figges方程计算活性SID (有效SID,SIDe)来表示的:

理论上,SIDa和SIDe的差值应为0(溶液中电荷的平衡)。如果没有电平衡,则用离子间隙(SAG) [SIG = SIDa - SIDe]表示:
C. 第三个理化模型是Gilfix为了解释和评价ABE而开发的,因为Stewart的模型不容易应用于日常临床实践。该模型引入了“碱剩余”(BE)一词,包括以下参数:i) 水(H2O)[特别是钠(Na )(稀释和浓缩),ii) 氯(Cl-),iii) 白蛋白(Alb),iv) 乳酸(Lactate)和v) 未测量阴离子(UMA)。BE指示的正值或负值分别表示碱化或酸化(图1)。

图1. ABE中离子正常值的示意图
I.与浓缩引起的代谢性碱中毒(MAlk)相反,液体过多造成血液稀释引起Na 浓度变化,导致代谢性酸中毒(MAc)。BENa 是由这个方程计算出来的:
BENa = 0.3x[Na 实测-Na 正常](mEq/L)
参数0.3是由SID(正常值40mEq/L)和血清[Na ](正常值140mEq/L,Na <133mEq/L为低钠血症)得出的结果。
ii. HCO3-浓度的变化,(小于22mEq /L可导致酸中毒,大于26mEq /L可导致碱中毒),伴随着Cl-浓度的逆向改变,分别导致高氯性MAc(Cl->109mEq /L)和低氯性MAlk的出现。BECl-是由这个方程计算出来的:
BECl-= Cl-正常-[Cl-实测x Na 正常/ Na 实测](mEq/L)
iii.白蛋白属于非挥发性酸类。因此,低蛋白血症意味着酸(弱酸)的丢失,从而导致低蛋白血症代谢性碱中毒(MAlk)的出现。BEAlb是由这个方程计算出来的:
BEAlb= (0.148 x pH-0.818)x(Alb正常-Alb实测)(mmol/L)
BEAlb> 5mmol /l为低蛋白血症碱中毒
iv.乳酸生成增加,导致高乳酸血症出现乳酸代谢性酸中毒(MAc)。BElactate是由这个方程计算出来的:
BElactate= Lactate正常- Lactate实测(mmol/L)
v.BE值不仅仅与水, Na ,Cl-,白蛋白,乳酸的变化有关,同时也受UMA(如酮类、有机酸类)的影响。BEUMA是由这个方程计算出来的:
BEUMA= BE总-[BENa BECl- BEAlb BENa BElactate](mEq/L)
钙、镁、钾、磷元素在ABE中的作用不明显,它们的浓度与钠、氯相比较低。BEUMA≤-5mEq/L在临床上认为存在未测量阴离子。
1.2 肝脏和ABE
肝脏通过四种病理生理机制参与ABE的调控:a)乳酸代谢;b)白蛋白稳态;c)酮体的生成和d)尿素的产生
a)乳酸主要在肝脏代谢(70%),它在肝脏首先代谢为丙酮酸,然后通过糖异生作用转化为葡萄糖。乳酸在肌肉中生成、在肝脏转化为葡萄糖的过程被称为Cori循环,同时产生HCO3-。乳酸酸中毒常见于重症监护病房(ICU)的患者,是由于组织缺氧(灌注减少),交感神经兴奋肾上腺素释放引起血管收缩,乳酸清除减低。乳酸在肌肉蓄积,经肝脏代谢减低,碱基生产减少,出现乳酸酸中毒。
b)在正常情况下白蛋白表现为弱酸性。低蛋白血症由于生产减少(肝衰竭)或消耗增加(肾病综合征)引起,导致轻度MAlk,而高蛋白血症见于脱水情况下,伴有轻度MAc。
C)肝脏中脂肪(线粒体)的分解代谢,生成酮酸(β-羟基丁酸和乙酰乙酸),分解生成H ,经小肠排出体外。酮酸的生成和代谢是一个反馈过程,pH(酸性环境)降低酮酸生产减少,相反pH值升高酮酸生成增加。正常情况下,肝脏生酮对ABE调节的影响较小。然而,在饥饿或酒精中毒的情况下,机体通过脂肪代谢产生能量,引起的严重的MAc。
d)每100g蛋白质可产生1mol (1000 mmol)NH4 (弱酸性铵)。在肝脏中NH4 被代谢成尿素,由肾脏排出体外。NH4 的代谢需要消耗等量的强碱[HCO3-]。因此,尿素的产生是一种酸化过程,在ABE的调控中起着重要的作用。
1.3 肝病中的酸化和碱化因素
综上所述,肝脏参与了ABE的调节。然而肝脏疾病(肝硬化、ICU患者肝硬化、急性或慢性肝衰竭伴或不伴肝硬化)会出现各种ABE紊乱。此外,由于肝损伤(肾功能衰竭引起和肝性脑病)对其他器官或系统的损害会加重已经存在的ABE紊乱。一些研究表明评价ABE紊乱的标准指标,可能无法检测肝病中复杂的ABE紊乱。相反,使用上述理化模型可揭示肝病中潜在的ABE紊乱。接下来,我们将简要介绍在肝病特别是肝硬化中与ABE有关的酸化和碱化因素。
1)碱化的因素
a)标准指标和理化模型都表明了,肝脏疾病中ABE紊乱是伴有明显低碳酸血症的呼吸性碱中毒(RAlk)(图2)。大量腹水合并肝性胸水,引起缺氧、呼吸急促、过度换气,导致低碳酸血症。Scheiner等报道了1例55岁肝硬化患者出现pH值增高伴低碳酸血症,提示呼吸性碱中毒,肝性脑病、腹水、呼吸困难为主要诱因。NH4 浓度的增加以及肝性脑病的进展都会加重肺过度通气。Lustik的一项研究表明,孕酮和雌二醇浓度的增加(肝脏分解代谢减少)可能会刺激中枢神经系统(CNS)中的孕酮受体出现过度换气。

图2. 肝病患者过度换气及呼吸性碱中毒的原因:肝性胸水、肝性脑病、孕酮和雌二醇水平升高以及肝肺综合征和门脉性肺动脉高压可导致过度换气。
b)尿素生成的减少导致[[HCO3-]代谢下降出现MAlk。然而,若存在继发性醛固酮增多症或严重低钾血症,除非使用利尿剂、抗酸剂,一般不出现MAlk。
c)低蛋白血症可能是肝硬化患者发生低蛋白血症MAlk的最重要因素。白蛋白每下降1g/dL,碱基(HCO3-)增加3.7mEq/L。需要注意的是,在肝硬化的早期白蛋白开始减少,由于摄入蛋白质减少,影响了蛋白质和氨基酸的代谢,因此低蛋白血症是ICU患者发生MAlk的主要原因。
2) 酸化的因素
a)低钠血症(血清Na <135mEq/L)是肝硬化和腹水患者常见的(>50%)电解质紊乱。低钠血症是由于有效循环血容量减少,刺激肾素-血管紧张素-醛固酮系统释放抗利尿激素,增加肾小管对水的重吸收(见于肝肾综合征)。此外,反复穿刺治疗腹水也会引起低钠血症。稀释型低钠血症[自由水H2O潴留(pH=7.00),见于肝硬化和腹水患者]可作为酸化因子,从而导致酸中毒,称为低钠性酸中毒。
b)Cl-替代HCO3-(电位平衡)引起高氯血症MAc,这是肝硬化和腹水患者的另一个酸化因素。Scheiner等人报导了一例46岁的肝硬化患者,BE为负值,pH呈酸性,提示代谢性酸中毒,输注含氯溶液后,出现高氯酸血症。在高氯性MAc患者中,纠正了ABE紊乱,即RAlk。在急性RAlk中,由于蛋白和磷(Pi)起着重要作用,调节快速(5-10min)。然而,慢性RAlk患者(需要2-3天)通过肾脏的两种代偿机制完成:1)减少排酸(肾小管泌H 减少);2)增加HCO3-排出,相应Cl-重吸收增加。
c)肝硬化患者高氯血症MAc的另一个情况多见于肝性脑病患者腹泻(服用乳果糖的患者)引起HCO3-的流失、Cl-重吸收。此外,这些酸中毒的患者表现为I型肾小管性酸中毒(不能酸化尿,pH>5.3),这是由于远端肾小管分泌H 和Cl-障碍,相应的H -Na 的交换减少。
1.4 ABE和肝脏疾病
1.4.1 肝硬化
肝硬化患者的ABE紊乱尚不完全清楚。这是因为这些疾病涉及多个机制,引起原发性和代偿性ABE紊乱。肝硬化ABE最常见的疾病是低碳酸血症的RAlk。然而,其他疾病是由于上述机制的肝功能障碍引起的,如MAc(稀释和高氯血症)和MAlk(低蛋白血症和尿素合成减少)。ABE (MAc和MAlk)的这些紊乱(相反)的结果是平衡的,且代偿期的肝硬化患者没有pH值的变化(20%),或者不足以被评估的微小变化。这被认为是没有危害的ABE紊乱,尽管存在三重ABE表现(图3)。

图3(图片错误,号内回复“酸碱”,获取正图). 酸碱变化的机制与最终血液pH值表现示意图。
对于低碳酸血症的RAlk,它主要是由于肾脏HCO3-排出减少,尽管并存的低血容量(有效循环血容量减少)导致重吸收增加。值得注意的是,以肝脏疾病-肺血管扩张-血液氧合降低三联征为特征的肝肺综合征也是肝硬化患者ABE紊乱的重要原因。这些患者出现肺动脉内吻合(分流或瘘管),动脉血从右至左流向静脉网,最终导致肺动脉高压,随之血气(O2, CO2)发生变化。
根据临床表现和病理变化的不同,这些患者表现为:RAlk 44.83%, MAlk 14.28%, MAc 6.12%,RAc 6.12%,MAc MAlk 8.16%,pH值正常占20.7%。
1.4.2 ICU肝硬化患者
如前所述,在肝硬化中,MAlk(低蛋白血症)、MAc(稀释和高氯血症),与RAlk(低碳酸血症)以及其他ABE紊乱同时存在,这些紊乱/代偿的结果是pH保持相对不变。然而,在ICU收治的肝硬化患者中,对ABE的造成主要影响的是乳酸(>1.9-2.0mmol/L)。乳酸的增加一方面是由于生成增加(>1500mmol/天)(组织灌注不足、缺氧,因脓毒症、高分解代谢综合征引起细胞代谢受阻),另一方面是由于肝脏分解代谢减少(肝功能受损、脓毒症)。相比代偿期的肝硬化患者,这些患者由于乳酸增加,MAc占主导地位,BE值减少(图4),多器官衰竭增加了死亡率。值得注意的是,一小部分乳酸在肾脏内代谢(5%),因此乳酸酸中毒的患者并存肾功能不全的病理改变(肝肾综合征)。
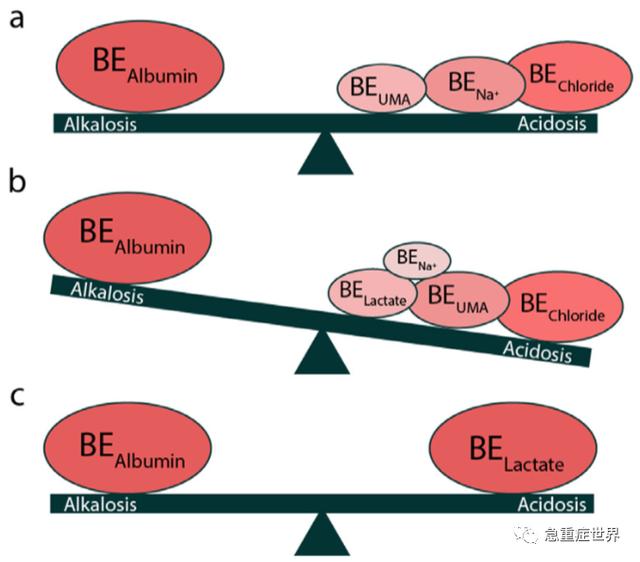
图4. ABE在慢性肝病患者中的应用a)代偿期肝硬化ABE影响因素;b)危重肝硬化代谢性酸中毒的影响因素;c)在急性肝衰竭中,低蛋白碱中毒对乳酸酸中毒的中和作用。BE:剩余碱;UMA:未测定阴离子
1.4.3 急性肝功能不全
大面积烧伤、急性呼吸衰竭和脓毒症可引起急性肝衰竭。在这些病例中,乳酸生成过多主要是由于急性肝功能障碍引起的(肺组织正常)。这种情况是以应激性高乳酸血症为表现(在无氧情况下,儿茶酚胺和其他细胞因子诱导的大量细胞摄取葡萄糖,即糖酵解)。在轻度急性肝损伤(I, II)中,没有观察到明显的pH紊乱,因为涉及的机制(代偿性和失代偿性)是平衡的,而在较严重的阶段(III, IV)乳酸酸中毒主要伴有RAlk。
2 结论
肝硬化患者伴呼吸性碱中毒(最常见)、代谢性碱中毒、代谢性酸中毒、呼吸性酸中毒和混合性酸碱平衡紊乱。传统模式并不足以识别临床酸碱紊乱,由于肝硬化的病理生理机制与ABE均存在可代偿空间,导致大量患者动脉血pH无明显变化。理化模型应被用来评估特定病理情况下的酸碱平衡,在这些情况下,综合评估潜在的ABE紊乱,有益于患者的治疗。
来源:Katopodis P,Pappas EM,Katopodis KP.Acid-base abnormalities and liver dysfunction[J]. Ann Hepato,2022,27(2):100675. Doi: 10.1016/j.aohep.2022.100675.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






