萜类和甾族化合物的生物合成(小檗碱和两面针碱的调控多样性合成)
黄连和两面针是民族药材库中的瑰宝,早在一千八百年前的汉代,中国首部中药典籍《神农本草经》就系统总结了黄连和两面针(蔓椒)的药用价值。小檗碱和两面针碱作为黄连和两面针的主要活性成分,具有广泛的生物活性和药物研究价值。近年在药物化学家不断的努力下,一系列重要进展被报道:1999年,日本科学家Fujiwara报道小檗碱可以通过抑制环氧化酶-2在结肠癌细胞中的表达,从而抑制结肠癌;2006年,葛兰素史克制药公司科学家Brusq报道了小檗碱通过激活AMP(单磷酸腺苷)激酶,抑制脂质合成从而降脂的原理;同年,上海药物所李佳研究员报道了小檗碱可能通过AMP(单磷酸腺苷)-AMPK(腺苷酸活化蛋白激酶)-p38MAPK(p38丝裂原活化蛋白激酶)通路,影响葡萄糖摄取达到降血糖的作用;2007年,日本科学家Maruyama报道了小檗碱通过调节人神经胶质瘤细胞中的β-淀粉样前体蛋白以降低该蛋白的产生,从而起到对阿尔茨海默症的治疗效果;2018年,中国医学科学院宋丹青研究员报道了多个小檗碱修饰物,作为以吲哚胺2,3-双加氧酶为靶点的肿瘤免疫治疗分子;2019年,上海药物所蒋华良院士团队通过对小檗碱分子改造,获得抗前列腺增生的I类新药喹诺利辛,顺利进入临床一期,这为基于小檗碱分子结构的药物发现开辟了里程碑式的突破。

图1. 小檗碱和两面针碱的构效关系
小檗碱和两面针碱的药物构效关系如图1。对于小檗碱骨架,胡椒基在降糖调脂和抗癌作用中必须保留,但其代谢不稳定;7位N修饰是通过异喹啉环还原后季铵化,N阳离子中心对于抗肿瘤作用有较大影响;8和13位主要是烷基修饰,链长短影响小檗碱脂溶性,亲脂性修饰可以提高抗菌活性,但会降低抗肿瘤活性;9位甲氧基可以选择性脱除得到酚羟基,进而通过酯键、醚键等方式进行连接,是修饰最多的位点,多数可以提高抗肿瘤活性,连接基团不同对各类癌细胞具有多样的活性(如9-O-二烯基小檗碱抗人肝癌细胞活性是小檗碱的102倍;9-O-桂皮酸小檗碱在浓度30 mg/(Kg•D)时对小鼠腹膜内肉瘤菌株有95%的抑制作用);10、11和12位点修饰后会影响降脂活性。对于两面针碱骨架,1位修饰报道较少,引入芳基可以提高抗菌活性;6位氧化成酰胺,同时5位N上连接不同末端脂肪胺,能够提高抗Topo I(拓扑异构酶I)的活性,从而提高以Topo I为靶点的抗癌活性,如结肠癌、急性淋巴白血病等;在7和8位引入烷基醚,可增强抗宫颈癌活性;在9、11和12引入脂肪胺,或将12位C用N原子替换,均可以提高抗Topo I活性。
就目前对这两类生物碱的结构改造,小檗碱的研究主要集中于对小檗碱分子官能团的直接修饰,这种做法限制了小檗碱骨架改造的官能团多样性和位点选择性:如小檗碱1和4位修饰,通常运用亲电反应进行烷基化或酰基化,无法实现化学选择性,更可能发生的位点是12位;5和6位烷基链的修饰则更加困难,在非氧化芳香化的条件下,只能通过自由基反应实现修饰,而异喹啉季铵盐并不能有效兼容自由基。而对两面针碱骨架,为了在合成过程中避免化学选择性问题的出现,2和3位往往都是相同官能团,同时4位的修饰也未见报道;1和12位的修饰主要在两面针骨架上进行的亲电反应,如傅克烷基化与酰基化,化学反应模型单一,官能团选择性受限;6位修饰主要通过5位N季铵化后亲核反应,如醇、胺、格氏试剂的进攻,往往只能引入醚、脂肪胺或烷基链。因此,开发官能团兼容性好和修饰位点多的新合成路线,将对这两类生物碱成药发现起到推动作用。
华东师范大学姜雪峰课题组基于“生物碱调控多样性合成”理念 (Angew. Chem. Int. Ed., 2015, 54, 14960; J. Am. Chem. Soc., 2016, 138, 5218; Angew. Chem. Int. Ed., 2018, 57, 9028; J. Am. Chem. Soc., 2021, 143, 1334.),对原小檗碱和原两面针碱进行了“统一”逆合成分析:原小檗碱和原两面针碱分别通过B环的C-N键切断和C-C键切断,得到一个共同的3-芳基异喹啉高级中间体,这一中间体可以由A环和C-D环通过Suzuki偶联实现,其中A环通过设计的环硼酸来定向偶联位点,C-D环3-卤代异喹啉则可由吡啶炔与取代呋喃环加成产物获得(图2)。这样整个合成就会实现高效简洁:1)一个前体,高选择性获得多取代吡啶炔;2)两个家族,原小檗碱和原两面针碱调控多样性合成;3)三个模块,汇聚式合成得到核心中间体。
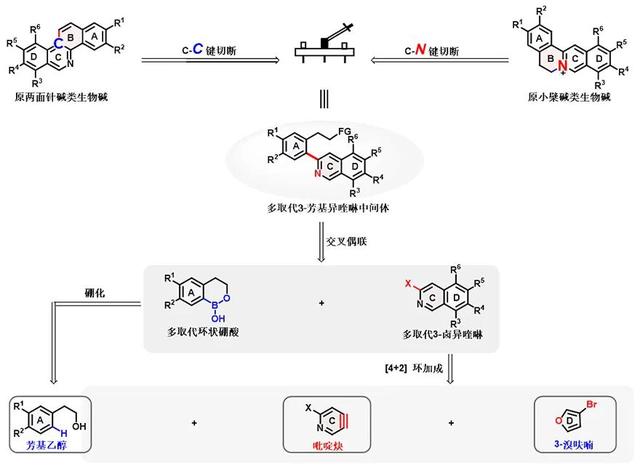
图2. 原小檗碱和原两面针碱的逆合成分析
基于此策略,他们首先设计合成了模块A共4个不同取代的环硼酸化合物(图3);其次通过设计高碘盐作为芳炔前体离去基,仅在温和条件下(叔丁醇钾为碱)即可获得多样性吡啶炔中间体模块C,与3-溴呋喃模块D发生环加成得到氧桥环产物,采用一价铱与三价钪串联催化一锅合成3-氯异喹啉,同时实现氧桥环C-O键选择性断裂,共合成8个不同取代基的3-卤异喹啉模块C-D;再与4个环硼酸模块A以排列组合的形式发生Ullmann-Ma偶联,获得24个3-芳基异喹啉高级中间体模块A-C-D(图5)。

图3. 模块A的合成

图4. 模块C-D的合成
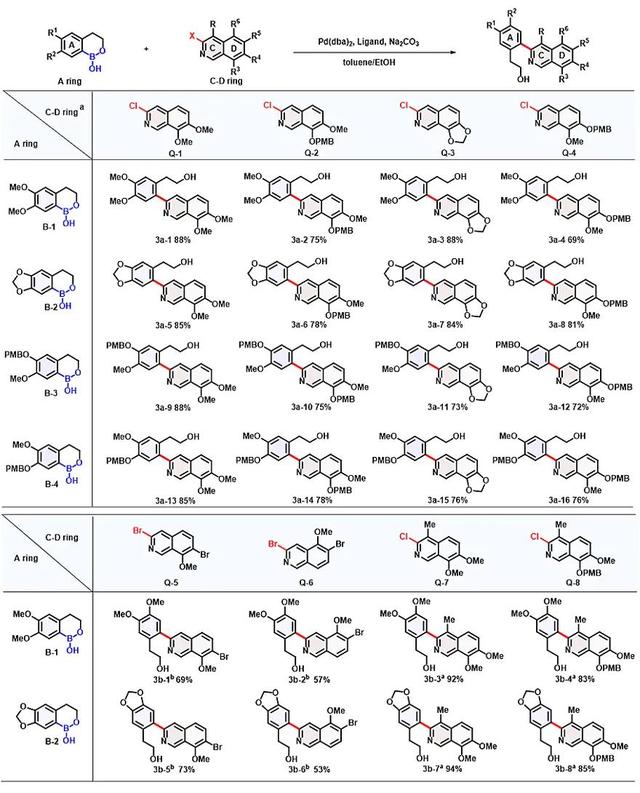
图5. 模块A-C-D的合成
基于不同反应途径,随后调控实现了C-N键与C-C键连接来构建B环,集群式地合成了原小檗碱和原两面针碱两个家族天然产物。一方面,3-芳基异喹啉通过甲磺酰氯对醇羟基活化后发生分子内SN2亲核取代,获得24个原小檗碱类生物碱及其衍生物(图6与图7),并实现了脱氢紫堇碱(Dehydrocorydaline)的克级合成。另一方面,130 ℃下用氢氧化钾对芳基乙醇攫氢消除现场获得芳基乙烯,可见光(λ = 450 nm)照射发生6-π电环化实现C-C键连接,合成12个原两面针碱类生物碱及其类似物(图6)。

图6. 原小檗碱和原两面针碱两个家族调控合成
通过设计多取代吡啶炔和发展铱钪串联催化,快速获得3-卤异喹啉,模块化、汇聚式、多样性、家族式地调控合成36个原小檗碱和原两面针碱类生物碱。初步药效探究便获得了相较于胰腺癌治疗药物吉西他滨11%抑制率更好的结果23%(图8)。

图7. 原小檗碱类生物碱及衍生物的合成
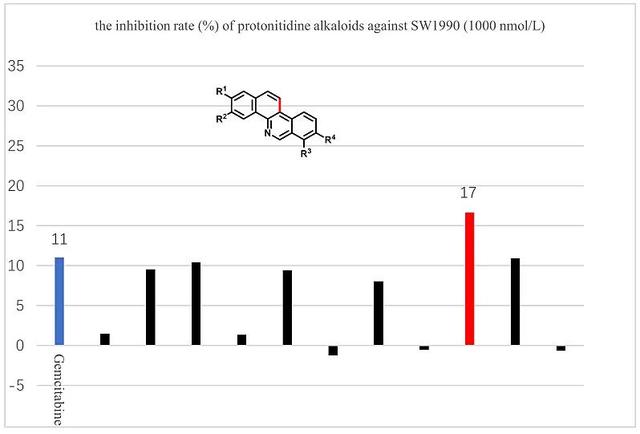

图8. 原小檗碱和两面针碱类生物碱及其衍生物对人胰腺癌SW1990细胞抑制作用
这一研究成果近期已经在线发表于Org. Lett.上。
Modular and Divergent Syntheses of Protoberberine and Protonitidine Alkaloids
Kai Liu, Xuefeng Jiang
Org. Lett., 2021, DOI: 10.1021/acs.orglett.0c04310
导师介绍
姜雪峰
https://www.x-mol.com/groups/Jiang_Xuefeng
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






