填漏补缺小题训练四(347)
本试卷分选择题和非选择题两部分。满分56分,考试时间30分钟。
可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 K—39 Cl—35.5 Mn—55 Fe—56 Zn—65
选择题
一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
7.化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
A.海水资源丰富,从海水中可以获得溴、钾、镁、烧碱等物质
B.小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂
C.苯是一种重要的化工原料,可以从煤干馏中获得苯
D.大气中的SO2、NO2是酸性氧化物,与酸雨的形成密切相关
解析 从海水中可以获得溴、钾、镁和烧碱等物质,A项正确;小苏打是NaHCO3,可作糕点的膨松剂,也可治疗胃酸过多,B项正确;苯可以从煤干馏中得到,C项正确;SO2、NO2与酸雨的形成密切相关,但NO2不属于酸性氧化物,D项错误。
答案 D
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.2.0 g Heq \o\al(18,2)O与2.0 g D2O中所含的中子数均为NA
B.14 g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C.100 g质量分数为17%的H2O2水溶液中氢原子数为NA
D.常温下,将56 g铁片投入到足量的浓硫酸中生成SO2的分子数为1.5NA
解析 A.2.0 g Heq \o\al(18,2)O所含的中子数eq \f(2.0 g,20 g·mol-1)(18-8)NA=NA与2.0 g D2O中所含的中子数eq \f(2.0 g,20 g·mol-1)[(2-1)×2+(16-8)]NA=NA,均为NA,故A正确;B.14 g分子式为CnH2n的烯烃的物质的量为eq \f(14 g,14n g·mol-1)=eq \f(1,n)mol,含有的碳碳双键数为NA/n,但分子式为CnH2n的烃不一定为烯烃,如是环烷烃,则没有碳碳双键,故B错误;C.水和双氧水中均含有氢原子,100 g质量分数为17%的H2O2水溶液中氢原子数多于NA,故C错误;D.常温下,铁在浓硫酸中钝化,将56 g铁片投入到足量的浓硫酸中生成SO2的分子数少于1.5NA,故D错误;故选A。
答案 A
9.已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A.原子半径:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X的原子序数差为5,则形成化合物的化学式为X3W2
解析 根据提供的信息,可以推断出W在X、Y、Z的上一周期,故原子半径:X>Y>Z>W,A项正确;W、Z同主族,非金属性:W>Z,但W的含氧酸的酸性不一定比Z的含氧酸的酸性强,B项错误;W、Z同主族,非金属性:W>Z,Y、Z同周期,非金属性:Y<Z,故非金属性:W>Y,W的气态氢化物的稳定性大于Y的气态氢化物的稳定性,C项错误;若W与X的原子序数差为5。且四种元素中只有X为金属元素,则X为Mg时W为N,X为Al时W为O,二者形成化合物的化学式为Mg3N2或Al2O3,D项错误。
答案 A
10.(2018·河北五校联考)分子中碳与氢两元素的质量比为21∶4的烃中主链上有5个碳原子的结构共有( )
A.3种 B.4种
C.5种 D.6种
解析 碳与氢的质量比为21∶4,即物质的量之比为eq \f(21,12)∶eq \f(4,1),化简为7∶16,分子式为C7H16,属于烷烃,主链上有5个碳原子的结构:

(另一个甲基可以在①②③位置上移动,有3种)、

、

,共有5种,故选项C正确。
答案 C
11.(2018·山东济宁高三期末)高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是( )

A.a为阳极,电极反应式为Fe-6e-+8OH-===FeOeq \o\al(2-,4)+4H2O
B.为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C.在电解过程中溶液中的阳离子向a极移动
D.铁电极上有少量气体产生原因可能是4OH--4e-===O2↑+2H2O
解析 铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,所以铁是阳极,电极反应式为Fe-6e-+8OH-===FeOeq \o\al(2-,4)+4H2O,故A正确;阳离子交换膜可以阻止FeOeq \o\al(2-,4)进入阴极区域,故B正确;在电解过程中溶液中的阳离子向阴极移动,所以阳离子向b极移动,故C错误;铁电极上发生氧化反应,所以生成的气体可能是氧气,电极反应式是4OH--4e-===O2↑+2H2O,故D正确。
答案 C
12.298 K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式:c(HCOO-)+c(HCOOH)=0.100 mol·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )
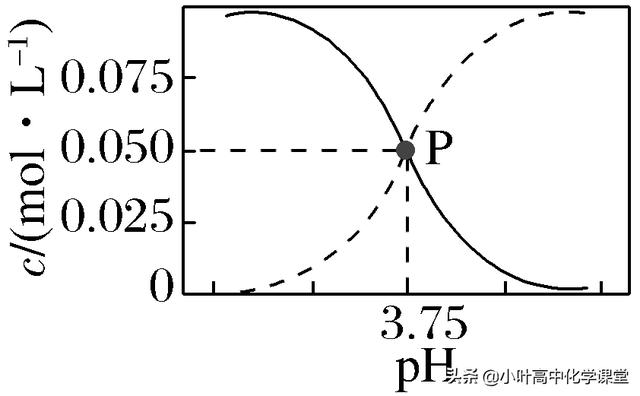
A.298 K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变
B.0.1 mol·L-1 HCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C.298 K时,HCOOH的电离常数Ka=1.0×10-3.75
D.0.1 mol·L-1 HCOONa溶液和0.1 mol·L-1 HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
解析 根据P点时,pH=3.75,c(HCOO-)=c(HCOOH),可得HCOOH的电离常数Ka=eq \f(c(HCOO-)·c(H+),c(HCOOH))=c(H+)=1.0×10-3.75,C项正确。298 K时,加蒸馏水稀释P点溶液,溶液中c(H+)·c(OH-)=Kw保持不变,但由于溶液体积增大,故n(H+)·n(OH-)增大,A项错误;0.1 mol·L-1 HCOONa溶液中,根据电荷守恒得,c(HCOO-)+c(OH-)=c(H+)+c(Na+),由于水解是微弱的,HCOONa溶液中c(Na+)>c(HCOOH),故c(HCOO-)+c(OH-)>c(H+)+c(HCOOH),B项错误;0.1 mol·L-1 HCOONa溶液和0.1 mol·L-1 HCOOH溶液等体积混合,HCOOH的电离程度和HCOO-的水解程度不同,因此c(HCOO-)≠c(HCOOH),故溶液的pH≠3.75,D项错误。
答案 C
13.海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:

若在实验室模拟该流程,下列关于该流程中各步骤的说法,错误的是( )
解析 步骤①分离得到滤液和不溶性物质,显然是分离固液混合物,其操作为过滤,需要漏斗、烧杯等仪器,A项正确;步骤②分离得到有机层溶液和水层溶液,显然是分离互不相溶的液体混合物,其操作为分液,需要分液漏斗、烧杯等仪器,B项正确;步骤③是从水溶液中得到固体,其操作为蒸发,需要蒸发皿等仪器,而坩埚是灼烧固体的仪器,C项错误;步骤④是从有机层溶液中分离得到甲苯,显然是分离沸点不同的液体混合物,其操作为蒸馏,需要蒸馏烧瓶、酒精灯、温度计、冷凝管等仪器,D项正确。
答案 C
非选择题
26.(14分)(2018·北京四中高三期中)某化学小组在实验室模拟用软锰(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
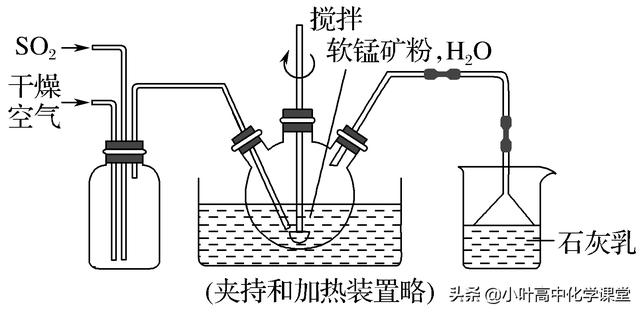
①缓慢向烧瓶中(见上图)通入过量混合气进行"浸锰"操作,主要反应原理为:
SO2+H2O===H2SO3 MnO2+H2SO3===MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向"浸锰"结束后的烧瓶中加入一定量纯MnO2粉末。
③再用Na2CO3溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5~7.2,加入NH4HCO3,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)"浸锰"反应中往往有副产物MnS2O6的生成,温度对"浸锰"反应的影响如下图,为减少MnS2O6的生成, "浸锰"的适宜温度是________。

(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯MnO2粉末的主要作用是_________________________________________,
相应反应的离子方程式为____________________________________
___________________________________________________________。
表1:生成相应氢氧化物的pH
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________________________________________________
______________________________________________________。
(4)④中加入NH4HCO3后发生反应的离子方程式是__________________________
_____________________________________________________________。
解析 (1)从图中得到150 ℃以上,副产物MnS2O6就不会生成了,同时锰的浸出率也是接近100%,所以选择150 ℃(或150 ℃以上)。
(2)根据表中数据,pH=3.5时,得到的主要是氢氧化铁沉淀,所以上一步中加入MnO2的目的是为了氧化亚铁离子(题目中说:铁浸出后,过量的SO2会将Fe3+还原为Fe2+)。反应为:MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O,考虑到题目认为得到亚铁离子是因为二氧化硫过量,所以加入的二氧化锰也可以将过量的二氧化硫氧化,反应为:MnO2+SO2===Mn2++SOeq \o\al(2-,4)。
(3)MnS投入水中的沉淀溶解平衡为:MnS(s)

Mn2+(aq)+S2-(aq),溶液中的铜离子会结合硫离子形成CuS沉淀,从而使反应平衡不断向右移动,将MnS沉淀转化为CuS沉淀,再经过滤就可以达到除去Cu2+的目的。当然能进行如上转化的前提是:CuS的溶解度更小。
(4)加入碳酸氢铵生成碳酸锰沉淀,则Mn2+结合了碳酸氢根电离的碳酸根离子,使电离平衡:HCO

H++COeq \o\al(2-,3)正向移动,电离的H+再结合HCOeq \o\al(-,3)得到CO2,方程式为:Mn2++2HCOeq \o\al(-,3)===MnCO3↓+CO2↑+H2O。
答案 (1)150 ℃(或150 ℃以上)
(2)Fe(OH)3 ②将Fe2+氧化为Fe3+,将过量的SO2氧化除去 MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O,MnO2+SO2===Mn2++SOeq \o\al(2-,4)
(3)MnS(s)

Mn2+(aq)+S2-(aq)、Cu2+(aq)+S2-(aq)

CuS(s) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去
(4)Mn2++2HCOeq \o\al(-,3)===MnCO3↓+CO2↑+H2O
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






