osuf干细胞(EMBO揭开活细胞中液泡融合孔的)
达戈斯蒂诺的手稿等人液泡融合的研究和最近的文献分析了细胞膜上的胞吐现象,结合先进的成像技术,提高了时间和空间分辨率,为揭示融合孔在不同传输阶段的“秘密”生命和结构组成奠定了基础。
01论文ID
原名:Uncovering the “secret” lives of vacuolar fusion pores in living cells
译名:揭开活细胞中液泡融合孔的“秘密”
期刊年卷:EMBO J(2018)37:E 100656
通讯作者:Thomas H Söllner
作者单位:海德堡大学生物化学中心,德国海德堡
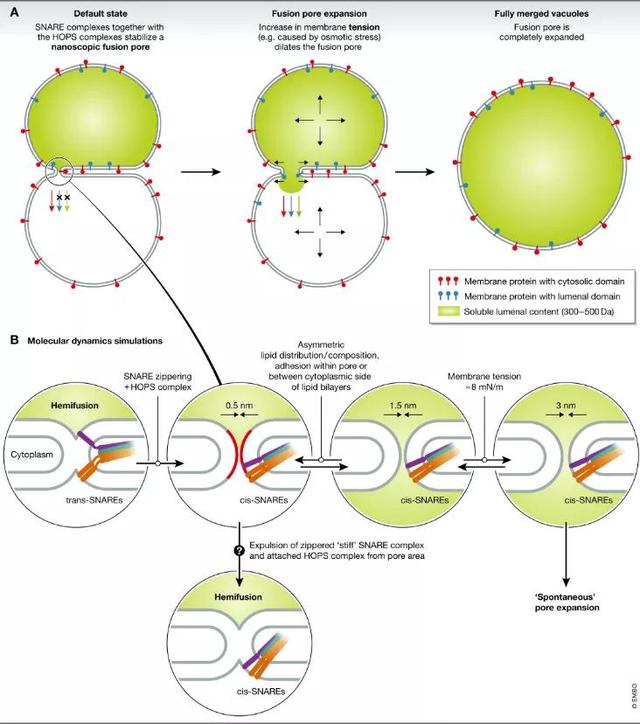
图1.液泡融合孔中间体
(A)液泡聚变孔膨胀是由膜张力增加所驱动的。(B)分子动力学模拟,说明潜在的融合孔中间体。
02简单介绍
据预测,非膨胀的融合孔将在从细胞外吞到细胞融合的广泛融合过程中构成限速亚稳态中间体。而,它们的存在和性质,特别是在细胞内的非外生空间中,基本上仍然是无形的。
在这个问题上,D‘Agostino等人证明不膨胀的毛孔很可能是酵母液泡中长期存在的稳态中间产物,使细胞能够根据迅速变化的生理调节其体积。这些孔是稳定的关闭,通过圈套和附液泡囊栓复杂的啤酒花。它们的膨胀是通过增加膜张力来控制的。
膜融合是发生在分泌和内吞途径上的一种普遍存在的事件,它在细胞间穿梭,调控多种生理事件,如激素分泌/神经递质释放,或溶酶体/空泡内(自噬)和胞外(吞噬)物质的消化。
经过几十年的深入研究,膜系因子(Rab和Rab-效应因子)、蛋白质启动和触发融合(Munc13和Synaptoagmin家族成员)以及融合机制的核心成分(snare和SM蛋白)已经被鉴定出来,它们协调了一系列的反应,最终导致了脂质双层的合并(Wickner和Rizo,Wickner和Rizo),2017)。然而,最终的步骤--聚变孔隙的形成和膨胀--在很大程度上仍然难以实现。
大多数进展都是研究细胞膜上调节的胞吐,显示可逆性的孔隙闪烁(接吻和奔跑/停留)和最近的动态融合孔(Alabi&Tsien,2013辛等人, 2018)。对于胞内小室中的融合孔所知甚少。一个普遍的假设是,在完全拉链的网状结构克服了能量障碍,开始膜融合后,这种孔会迅速膨胀。在本期EMBO杂志达戈斯蒂诺等人 (2018)提供关于活酵母细胞液泡融合孔的大小和动态/寿命的惊人结果。
酵母液泡几乎是球形的,它们的数量取决于细胞的生理状态,而且通常是相互拴在一起的。为了适应环境条件的变化,例如快速变化的渗透压,液泡会经历分裂/分裂(高渗介质)或聚变(低渗介质),从而避免潜在的灾难性破裂和液泡含量释放到胞质(Desfugeres)。等人, 2016)。
由于液泡直径较大,可以通过常规荧光显微镜在活细胞中追踪,从而可以检测到液泡的含量混合和脂质混合,并存在较大的膨胀融合孔。以一种优雅的方式,D‘Agostino等人利用本实验系统,采用不同尺寸、不同性质的荧光染料、荧光共振能量转移(Fret)和光漂白后荧光恢复(Frap)技术,对液泡融合孔的性质进行了观察。
03
结论总的来说,这些显著的发现具有重要的意义:
- 先进的成像技术,如冷冻电子显微镜(cryo-EM)和聚焦离子束球磨结合扫描电子显微镜(FIB-SEM),将成为进一步提供有关聚变机械实际孔径和局部组织的结构信息的首选方法。
- 增加膜张力以打开聚变孔的要求与几个理论计算和最近分析质膜上胞吐事件的实验证据一致。
欢迎关注公众号启帆医学BioSCI, 创始人之一为留美海归生物医学博士,经过数年积累,汇聚了大批国内外顶级名校的教授、博士、博士后以及其他科研人员等强大人脉资源。公众号专注于生物医学研究、科研课题设计、SCI论文写作等领域的知识梳理和资料分享,为广大医务工作者提供便利。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com