高中化学氧化还原题型及答案(高三化学总复习)
往期链接:点击直达
1、高三总复习之常见物理分离方法
2、高三化学总复习,化学除杂方法,你知道多少?
3、化学总复习之阿伏伽德罗常数
4、高三化学总复习——离子共存,你真的理解了吗?
5、高三化学总复习,离子方程式怎样快速判断?
一、化学反应的分类:



1、有的化合反应是氧化还原反应:
例:

2、有的化合反应不是氧化还原反应:
例:
CaO H2O=Ca(OH)2
3、有的分解反应是氧化还原反应:
例:

4、有的分解反应不是氧化还原反应:
例:

5、所有的置换反应都是氧化还原反应:
由置换反应的定义:有单质参加和有单质生成,可知该反应一定有变价。
例:
Cl2 2KI = I2 2KCl
6、所有的复分解反应都不是氧化还原反应:
由复分解反应的定义:两种化合物的阴阳离子相互交换,可知该反应只存在离子的整体交换,没有价态变化。
例:
HCl NaOH=NaCl H2O
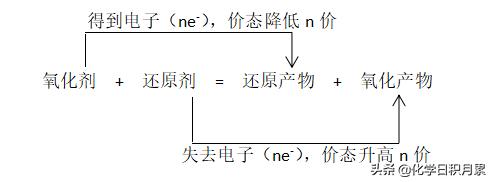
四、氧化还原反应四要素1、氧化剂:化合价降低的反应物
2、还原剂:化合价升高的反应物
3、还原产物:化合价降低的生成物
4、氧化产物:化合价升高的生成物
五、双线桥的画法1、步骤:
1)、通过标化合价找到变价元素
2)、通过变价元素找到四要素
3)、画线桥:
•由氧化剂指向还原产物
•由还原剂指向氧化产物
4)、标得失电子数:
•得(失)电子数=价态差值×变化的原子个数
5)、检查线桥上总得电子数是否等于总失电子数
2、注意事项:
a.箭头必须由反应物指向生成物,且两端对准同种元素。
b.箭头方向不代表电子转移的方向,仅表示电子转移前后的变化。
c.在"桥"上标明电子的"得"与"失",且得、失电子总数应相等。
3、双线桥得意义:
通过学习画双线桥,关键在于理解氧化还原得本质:有电子转移。当能够熟练画双线桥,通过方程式,一眼即可看到电子转移数时,双线桥的意义就失去了,
例:

1、氧化性:表示物质得电子的能力,物质得电子能力越强,该物质的氧化性就越强
氧化剂和氧化产物都有氧化性,且氧化剂>氧化产物
2、还原性:表示物质失电子的能力,物质失电子能力越强,该物质的还原性就越强
特别提示:
(1)氧化性、还原性强弱取决于得失电子的难易程度,与得失电子的数目无关。
(2)依据金属活动性顺序判断阳离子的氧化性强弱时,要注意Fe对应的阳离子是Fe2 ,而不是Fe3 。
3、比较氧化性、还原性的方法
1)、利用氧化还原方程式:
•氧化剂和氧化产物都有氧化性,且氧化剂>氧化产物
•还原剂和还原产物都有还原性,且还原剂>还原产物
2)、利用金属活动性(即还原性)顺序比较:
还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>Cu>Hg>Ag
氧化性:Ag >Hg2 >Cu2 >Pb2 >Sn2 >Fe2 >Zn2 >Al3 >Mg2 >Na >Ca2 >K
原子还原性越强,其离子的氧化性越弱
3)、利用非金属活动性(即氧化性)顺序比较:
氧化性:F2>Cl2>Br2>I2
还原性:I->Br->Cl->F-
原子氧化性越强,其离子的还原性越弱
4)、利用元素周期律比较:

5)、利用反应条件及反应的剧烈程度比较:
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
例:

6)、利用相同或相似条件下被氧化(或被还原)的程度比较:
①不同氧化剂作用于同一种还原剂,所得氧化产物的价态越高,相应的氧化剂的氧化性越强。
例:

②利用不同还原剂作用于同一种氧化剂,所得还原产物的价态越低,相应的还原剂的还原性越强。
例:
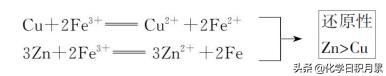
7)、利用"两池"比较:
①原电池:一般情况下,两种不同的金属构成原电池的两极,其还原性:
负极金属>正极金属
②电解池:用惰性电极电解混合溶液时:
阴极先放电的阳离子的氧化性较强
阳极先放电的阴离子的还原性较强
8)、利用"三度"比较:("三度"即:浓度、温度、酸碱度)
①浓度:同一种物质浓度越大,氧化性(或还原性)越强。
例:
氧化性:浓H2SO4>稀H2SO4 浓HNO3>稀HNO3
还原性:浓盐酸>稀盐酸
②温度:同一种物质,温度越高,其氧化性(或还原性)越强。
例:
氧化性:热的浓硫酸>冷的浓硫酸
③酸碱度:同一种物质,所处环境酸(碱)性越强,其氧化性(或还原性)越强。
例:
KMnO4溶液的氧化性随溶液酸性的增强而增强
七、氧化还原反应的规律1、守恒规律:
氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数。
或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价降低总数必等于升高总数。
应用:配平氧化还原反应方程式及进行有关计算。
2、强弱规律:
氧化性较强的氧化剂跟还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。
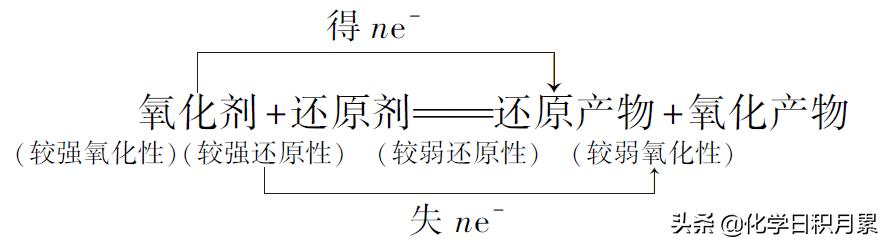
应用:在适宜条件下,用氧化性较强的物质制备还原性较弱的物质,或用还原性较强的物质制备氧化性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3、价态规律:
元素处于最高价态,只有氧化性;
元素处于最低价态,只有还原性;
元素处于中间价态,既有氧化性又有还原性,
但主要表现一种性质。物质中若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性或还原性。
4、转化规律:
氧化还原反应中,元素相邻价态之间的转化最容易;同种元素不同价态之间发生反应,元素的化合价只靠近而不交叉;同种元素相邻价态之间不发生氧化还原反应。


应用:判断氧化还原反应能否发生及表明电子转移情况。
5、难易规律:
越易失去电子的物质,失去电子后就越难得到电子;
越易得到电子的物质,得到电子后就越难失去电子。
一种氧化剂同时和几种还原剂相遇时,与还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,与氧化性最强的优先发生反应。
例:
FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
2Fe2 Cl2= 2Fe3 2Cl-,2Br- Cl2= Br2 2Cl-。
应用:判断物质的稳定性及反应顺序。
往期链接:点击直达
1、高三总复习之常见物理分离方法
2、高三化学总复习,化学除杂方法,你知道多少?
3、化学总复习之阿伏伽德罗常数
4、高三化学总复习——离子共存,你真的理解了吗?
5、高三化学总复习,离子方程式怎样快速判断?
如果您喜欢,可以收藏、点赞加关注,您的支持,是我继续推出文档的动力!
网页版,排版不太好,想要文字word文档的,请留言私信我!
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






