价电子层互斥理论计算公式(花5分钟3步彻底搞懂)
高中化学选修二物质结构中出现【价层电子对互斥理论】,表述得甚为复杂,绕来绕去,孩子们犯糊涂。原文如下:

高中化学选修二中价层电子对互斥理论
问题一:如何确立中心原子?
问题二:孤对电子数的计算需要这么复杂的方法吗?
问题三:如何快速掌握【价层电子对互斥理论】?
理论基础
一种简单、粗暴的解释、预判分子结构的理论,什么原子轨道、分子轨道的概念统统不需要。分子或原子团的几何构型主要决定于中心原子的价电子层中电子对的互相排斥作用,总是采取相互排斥作用最小的那种结构。电子对数为2时,180°斥力最小;电子对数为3时,120°斥力最小;电子对数为4时,109°28'斥力最小,具体如下图。

价层电子对数与几何构型的关系
实际预判
第一步:确定中心原子,在分子中形成的σ键数目大于2的原子,如H2O中的O有2个σ键;NH3中的N原子有3个σ键;硫酸根离子根离子中S有4个σ键;C2H6中的两个C都是中心原子,分别进行讨论,C1为中心原子时,C2作为配位原子,反之,C2为中心原子时,C1作为配位原子。与中心原子直接成σ键的叫配位原子。
第二步:计算价层电子对数,中心原子和各配位原子贡献的价层电子总和除以2(阴离子或阳离子应加或减相应电荷代数值),为价层电子对数。中心原子为主族元素时,价电子数跟族数有关。当卤族元素作中心原子时,价电子数为7;氧族元素作中心原子时,价电子数为6。当氢和卤素作配体原子时,贡献价电子数为1;氧和硫作配体原子时。提供价电子数为0,被戏称为抠门S和抠门O。

计算价层电子对数的规则
实例1:BeCl2,中心原子Be,价层电子对数=1/2(2 2*1)=2,直线型
实例2:磷酸根离子PO43-,中心原子P,价层电子对数=1/2(5 0 3)=4,正四面体
实例3:二氯化碘离子ICl2-,中心原子I,价层电子对数=1/2(7 2 1)=5,三角双锥?
答案:不是。为什么呢?请看:
第三步,计算孤对电子数,当价层电子对数等于配体个数时,电子构型与分子构型一致;当价层电子对数大于配体个数时,一定存在孤对电子数。实例3中,价层电子数为5,配体数为2,很显然,有3对孤对电子。因此,电子构型与分子构型不一致。实例3中,电子构型依然为三角双锥,而分子构型则取决于孤对电子有几对,和孤电子对分别摆放到什么位置。依据孤对电子-孤对电子>孤对电子-成键电子>成键电子-成键电子原则,可计算出,当价层电子对数为2、3、4时,孤对电子摆放位置怎么着都行;当价层电子对数为5,6时,孤对电子摆放位置有几种可能的选择方案。根据最小排斥原理,当价层电子对数为5时,孤对电子优先在“腰”上;当价层电子对数为6时,孤对电子优先在“轴”上。实例3中,有3对孤对电子,优先在“腰”上,因此ICl2-分子构型为直线型。

当价层电子对数与配体数不等时,分子构型与电子构型不一致

当电子构型为三角双锥时,分子构型可能为三角双锥、变形四面体、T型或线型
下图为具体实例。价层电子对互斥理论学会了吗?多多实践吧!
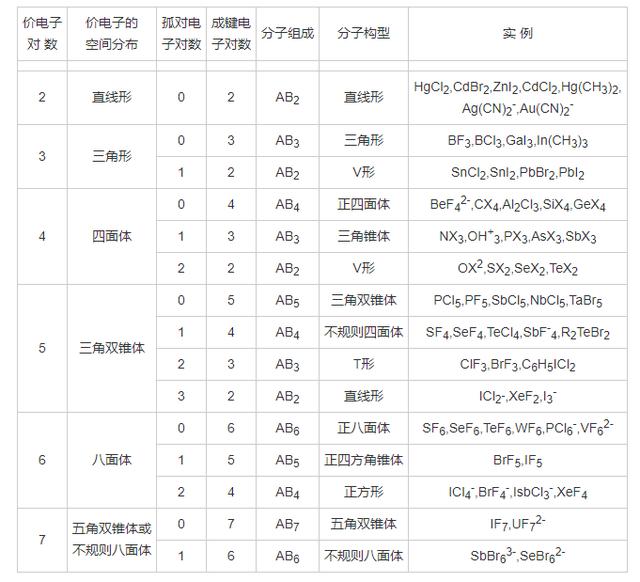
价层电子对互斥理论预测分子构型的实例
参考文献:
[1]朱斌.杂化轨道理论与价层电子对互斥理论应用于分子构型的比较研究[J].四川师范学院学报(自然科学版),2003,(02):240-244.
[2]百度文库ppt,链接如下:
https://wenku.baidu.com/view/a5fcb9104431b90d6c85c7e2.html?_wkts_=1675221985842&bdQuery=价层电子对互斥理论
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






